КОСМЕТИЧЕСКИЕ СРЕДСТВА CERAVE ДЛЯ УКРЕПЛЕНИЯ И ВОССТАНОВЛЕНИЯ БАРЬЕРНОЙ ФУНКЦИИ КОЖИ У ПАЦИЕНТОВ С ХРОНИЧЕСКИМИ ДЕРМАТОЗАМИ
12.09.2021
Баалбаки Нада, PhD
Доктор фармацевтических наук, факультет биофармацевтики Университета Цинтиннати, консультант бренда CeraVe, США
Одной из основных функций кожи является формирование барьера между внутренней средой организма и окружающим миром. Кожа не только защищает от воздействия внешних агентов (химических соединений, физических и механических факторов, биологических патогенов), но также препятствует потере воды, предотвращая обезвоживание организма [1, 2].
Барьерные структуры кожи локализованы в роговом слое эпидермиса. Корнеоциты (мертвые клетки рогового слоя) являются фундаментом эпидермального барьера, однако не менее важную функцию выполняют поверхностные липиды, которые условно можно разделить на две фракции:
- липиды рогового слоя — располагаются между роговыми чешуйками, формируя пласты (липидный барьер);
- липиды секрета сальных желез (себума) — входят в состав гидролипидной (или кислотной) мантии, покрывающей кожу снаружи.
Формирование защитных липидных структур рогового слоя происходит постепенно, по мере трансформации кератиноцита в корнеоцит [1].
В эпидермисе выделяют 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой. Кератиноциты (основные структурные клетки эпидермиса) берут свое начало от стволовых клеток базального слоя эпидермиса. В процессе перемещения кератиноцитов в зернистый слой в них образуется множество гранул:
- темные гранулы содержат белок кератогиалин, из которого потом будет формироваться главный белок рогового слоя кератин, а также профилаггрин — предшественник филаггрина* (* Филаггрин — структурный белок кожи, который принимает непосредственное участие в процессе кератинизации, специфически взаимодействуя с промежуточными филаментами кератина для организации их в плотную упорядоченную сеть, обеспечивающую роговому слою механическую прочность. — Прим. ред.);
- cветлые гранулы (ламеллярные тельца, тельца Одланда) заполнены липидами, которые играют ключевую роль при формировании барьера проницаемости рогового слоя, а также ферментами для их процессинга.
Ламеллярные тельца содержат преимущественно сфинголипиды, холестерин, фосфолипиды, а также катаболические ферменты и антимикробные пептиды. По мере превращения кератиноцита в корнеоцит ламеллярные тельца подходят к клеточной мембране, сливаются с ней и выплескивают свое содержимое во внеклеточное пространство. Под действием одновременно высвобождаемых ферментов липиды подвергаются дальнейшему метаболизму. В итоге из фосфолипидов (под действием фосфолипазы) образуются глицерин (известный своими влагоудерживающими свойствами) и свободные жирные кислоты (СЖК), а из сфинголипидов — церамиды (CER), которые собираются в слоистые структуры и формируют липидный барьер (рис. 1) [1].
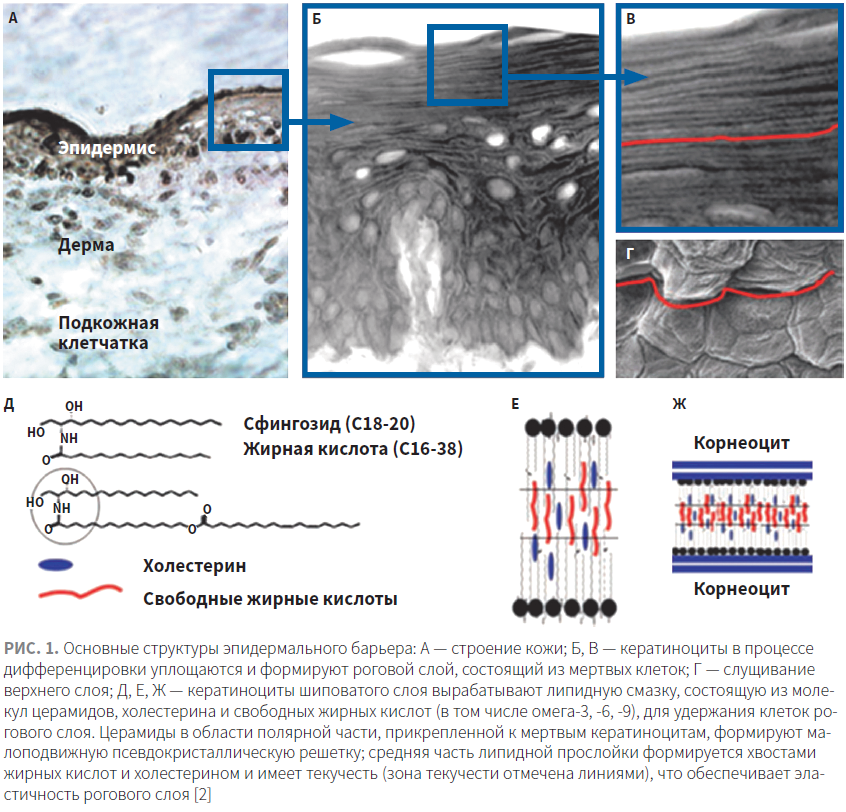
На состав липидов рогового слоя влияют возраст, генетическая предрасположенность, время года, диета (например, содержание в рационе незаменимых жирных кислот), а также лекарственные препараты.
Состав липидных пластов рогового слоя будет отличаться от состава липидов живых слоев эпидермиса. Если преобладающим классом жиров в случае живых слоев эпидермиса являются фосфолипиды клеточных мембран, то в случае рогового слоя доминирующие позиции будут равномерно распределены между тремя типами липидов: CER, холестерином и СЖК, содержащимися в эквимолярных количествах — 1 : 1 : 1 (т.е. на одну молекулу CER приходится по одной молекуле холестерина и СЖК); соотношения же этих липидов в расчете на массу представлены в таблице.
Таблица. Массовые соотношения различных видов липидов в составе рогового слоя [3]
|
Группа липидов |
Массовое содержание, % |
|
Церамиды |
40–50 |
|
Холестерин |
20–25 |
|
Сульфат холестерина |
5–10 |
|
Свободные жирные кислоты |
15–20 |
Именно пропорция 1 : 1 : 1 считается максимально физиологичной и обеспечивает хорошие барьерные функции рогового слоя.
Помимо этих главных липидов, в составе липидного барьера также присутствуют:
- сульфат холестерина — играет роль в десквамации роговых чешуек;
- свободные сфингоидные основания — образуются вследствие разрушения CER церамидазами, обладают антимикробными свойствами и регулируют процессы кератинизации за счет ингибирования протеинкиназы С [1].
Таким образом, для обеспечения структурной и барьерной целостности рогового слоя важен не только качественный состав, но и сбалансированное соотношение основных его компонентов.
Липидные слои расположены параллельно друг другу. Их разделяет тонкая водная прослойка, по которой вода перемещается по направлению к поверхности. Этот процесс называется трансэпидермальной потерей воды (ТЭПВ).
Нарушение структуры липидного барьера способствует продвижению воды к поверхности и ее потере за счет более быстрого испарения. Целостность липидного барьера обеспечивает контроль над испарением воды, поддержание уровня гидратации рогового слоя в норме, а также предотвращает попадание внутрь организма чужеродных веществ.
Целостность липидного барьера обеспечивает контроль над испарением воды, поддержание уровня гидратации рогового слоя в норме, а также предотвращает попадание внутрь организма чужеродных веществ.
Различные гидрофильные субстанции совместно с мочевиной (в концентрации до 10%) и молочной кислотой (в концентрации 5–10%) образуют натуральный увлажняющий фактор (natural moisturizing factor; NMF), препятствующий потере воды, колонизации патогенами, проникновению токсических веществ и аллергенов.
Дополнительную защиту обеспечивает секрет сальных желез (себум), состоящий из тугоплавких жиров — триглицеридов, эфиров восков, сквалена и некоторых СЖК. Покрывая поверхность кожи, он смягчает ее верхний слой, снижает потерю влаги, а кроме того, оказывает антимикробный эффект. Испарение воды тормозится как посредством приглаживания роговых чешуек, так и благодаря глицерину, присутствующему в составе себума. В то же время кислород и углекислый газ проходят через себум совершенно свободно. Себодефицит способствует развитию сухости и повышенной раздражимости кожи. Вместе с секретом потовых желез и веществами, образующимися непосредственно в роговом слое, себум формирует гидролипидную мантию — самую первую линию обороны кожи [3].
Генетические особенности являются основными определяющими факторами структурной и функциональной жизнеспособности эпидермального барьера. Врожденные генетические нарушения могут привести к дисфункции эпидермального барьера, увеличению ТЭПВ, хроническому воспалению и, как следствие, к сухости и повышенной чувствительности кожи, что наблюдается при многих хронических дерматозах с наследственной предрасположенностью, таких как атопический дерматит (АД) и псориаз [4]. Однако не менее весомое влияние на состояние эпидермального барьера и здоровье кожи может оказать такой мощный фактор, как образ жизни, и важным его компонентом является диета. Особенно остро этот вопрос стоит в отношении веганства.
Веганы и пациенты с хроническими дерматозами — что может быть общего?
Возможное влияние веганской диеты на состояние защитных функций кожи
Вегетарианство, в том числе одна из его наиболее строгих форм — веганство, переживает неуклонный рост своих приверженцев. Веганство представляет собой образ жизни, стремящийся к исключению всех форм эксплуатации и насилия в отношении животных — использования для еды, одежды или любых других целей. Веганы отказываются от потребления всех видов мяса, молока (не считая грудного молока при вскармливании младенцев), яиц, меда, а также других веществ и добавок, произведенных с использованием животных (таких как желатин или кармин).
Согласно последней статистике, на планете сейчас около 375 млн вегетарианцев. На Западе веганизм избавился от стигмы хиппи и превратился в образ жизни, которого придерживаются все больше и больше людей (например, в США количество веганов выросло на 600% между 2014 и 2017 гг.). Согласно опросу Vegetarian Resource Group, на 2016 г. в США веганства придерживалось 3,4% населения, в Европе — около 1% [5–7].
Для веганской диеты характерно высокое содержание растительных волокон, магния, фолиевой кислоты, витаминов C и E, растительных полифенолов с антиоксидантной и антипролиферативной активностью. Неудивительно, что подобный рацион питания служит эффективным средством профилактики и лечения кардиометаболических заболеваний и ассоциирован со снижением риска заболеваемости до 40%. Более того, риск метаболического синдрома и диабета 2-го типа уменьшается на 50%. При грамотном планировании растительная диета способствует снижению веса, уровня глюкозы, артериального давления, уровня липидов крови, а также регрессу атеросклероза [6].
Тем не менее низкая биодоступность некоторых микронутриентов в растительной пище может привести к дефициту питательных веществ.
Для приверженцев веганской диеты свойственен дефицит ряда витаминов — B12, B2, A, D, а также микроэлементов, таких как йод, кальций, железо, цинк и селен [7]. Кроме того, в вегетарианской диете обычно не хватает незаменимых омега-3 полиненасыщенных жирных кислот (ПНЖК), таких как эйкозапентаеновая (ЭПК) и докозагексаеновая (ДГК)* [8]. (* Эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК) — полиненасыщенные жирные кислоты (ПНЖК) класса омега-3, относятся к незаменимым жирным кислотам, содержатся в большом количестве в жире лосося и атлантической сельди, зоопланктоне, морских моллюсках, микроводорослях. ЭПК и ДГК входят в состав липидов большинства тканей животных, являются одним из главных компонентов комплексных липидов — Прим. ред.). Их недостаток отрицательно сказывается на регенеративной способности тканей, и особенно это актуально в отношении кожи, важным защитным звеном которой служит липидный барьер. ПНЖК необходимы для синтеза CER, скрепляющих соседние липидные пласты между собой и тем самым поддерживающих целостность барьера [9].
Низкий уровень холестерина крови, свойственный веганам, может привести к его недостатку в роговом слое. В свою очередь, для секрета сальных желез характерно более низкое содержание сквалена — промежуточного продукта в биосинтезе стероидов, который также является прямым предшественником холестерина. Он производится себоцитами, в составе себума выходит на поверхность кожи, выполняя роль защитника липидов рогового слоя от перекисного окисления.
Таким образом, дефицит холестерина и полиненасыщенных жирных кислот может нанести урон эпидермальному барьеру: кожа не сможет удерживать влагу и успешно противостоять проникновению аллергенов, поллютантов и патогенных микроорганизмов — в результате развивается сухость и состояние хронического воспаления. Подобное состояние похоже на то, что наблюдается у пациентов, страдающих хроническими дерматозами, такими как АД и псориаз. Поэтому веганам крайне важно проконсультироваться с врачом относительно того, как сбалансировать питание. Также необходимо понимать, как образ жизни — безотносительно ухода — может повлиять на барьер и здоровье кожи.
Хронические дерматозы — заболевания нарушенного эпидермального барьера
АД относится к хроническим воспалительным заболеваниям кожи и возникает у лиц с наследственной предрасположенностью. В его патогенезе выделяют два ключевых звена — иммунную дисрегуляцию и нарушение барьерной функции кожи.
У пациентов с АД часто наблюдается ряд характерных генетически обусловленных изменений эпидермального барьера:
- мутации в генах, приводящие к нарушению структуры филаггрина, — это сопровождается снижением уровня NMF, повышением индекса ТЭПВ, а также ухудшением эластичности кожи;
- врожденные дефекты корнеодесмосом и плотных контактов;
- генетически обусловленные изменения состава гидролипидной мантии [10].
Сквозь слабый барьер в кожу проникают чужеродные вещества и патогенные микроорганизмы, запуская каскад воспалительной реакции с соответствующей клинической картиной (рис. 2) [11, 12].

Псориаз — одно из наиболее распространенных аутоиммунных хронических кожных заболеваний. В ходе геномных сравнительных исследований очагов псориаза и здоровой кожи были обнаружены отличия более чем в 1000 генах, около 70 локусов хромосом, по-видимому, отвечают за развитие заболевания и лежат в основе генетической предрасположенности к псориазу [13]. Первичные дефекты эпидермального барьера обусловлены делециями в генах, участвующих в формировании рогового конверта и дифференцировке кератиноцитов. Подобные нарушения могут лежать в основе аномальной реакции на внешние факторы-раздражители при псориазе. Роговой слой утолщен, но не выполняет при этом свою защитную функцию из-за неправильной дифференцировки кератиноцитов.
При псориазе также наблюдается снижение уровня просапозина (участвует в липидном обмене), CER и сфингомиелина — компонентов клеточных мембран, что свидетельствует о нарушении липидного барьера [3].
Помимо первичных дефектов эпидермального барьера, в условиях хронического воспаления возникают вторичные нарушения: воспалительная реакция препятствует синтезу структурных компонентов эпидермального барьера, в том числе филаггрина.
Генетически обусловленные нарушения врожденных и приобретенных иммунных реакций на уровне кожи, а также эпидермального барьера приводят к возникновению и поддержанию воспаления в очагах псориаза в ответ на действие неблагоприятных внешних факторов [3].
Таким образом, нарушенный эпидермальный барьер служит пусковым звеном развития хронического воспаления, сухости и повышенной чувствительности кожи как при веганской диете, так и при хронических дерматозах.
Генетика и образ жизни могут нанести двойной удар по эпидермальному барьеру
Silverberg J.I. и соавт. проанализировали результаты Национального анкетирования по вопросам здоровья (США) от 2007 г. для оценки влияния методов комплементарной и нетрадиционной медицины (в том числе и различных диет) на развитие АД [14]. В ходе опроса были собраны данные 9417 детей в возрасте от 0 до 17 лет. Согласно статистическим подсчетам были определены методы комплементарной и нетрадиционной медицины, ассоциированные с повышенным риском развития АД, и к ним относится и веганская диета (рис. 3).
Хотя установить механизмы наблюдаемой взаимосвязи в полной мере не представляется возможным, веганская диета может, с одной стороны, способствовать нарушению эпидермального барьера, с другой — служить источником пищевых аллергенов. При наличии АД и пищевой аллергии пациент часто вынужден исключить из рациона питания ряд продуктов, список пищевых ограничений за счет этого расширяется, что может усугубить нехватку макро- и микронутриентов.
Следует отметить, что многие основные компоненты веганской диеты как раз имеют репутацию мощных аллергенов. Соя, арахис, лесной орех и пшеница — четыре из шести наиболее распространенных пищевых продуктов, служащих триггером IgE-опосредованных аллергических реакций. Соя также выступает вторым по частоте продуктом, вызывающим не связанную с IgE пищевую аллергию, что еще больше может ограничивать выбор для веганов-аллергиков [15–17].
Пациенты с пищевой аллергией потребляют значительно меньше кальция и белка и с большей вероятностью будут придерживаться диеты с дефицитом незаменимых жирных кислот [18]. Эти нарушения питания могут иметь прямые последствия для физического развития, минеральной плотности костей и состояния кожи [19].
Пациенты с пищевой аллергией потребляют значительно меньше кальция и белка и с большей вероятностью будут придерживаться диеты с дефицитом незаменимых жирных кислот. Эти нарушения питания могут иметь прямые последствия для физического развития, минеральной плотности костей и состояния кожи.
Особое внимание следует уделять количеству и качеству белка в веганской диете [20]. Многие продукты растительного происхождения, богатые белком, также являются распространенными аллергенами. В частности, это касается сои и миндаля: смеси на их основе выступают распространенной альтернативой смесям из коровьего молока. Для веганов с аллергией на орехи отказ от орехов может быть особенно трудным [21].
Некоторые группы имеют бо́льшую потребность в энергии и питательных веществах. Младенцам, детям и спортсменам, соблюдающим веганскую диету и страдающим пищевой аллергией, следует проявлять осторожность, чтобы обеспечить оптимальное потребление питательных веществ.
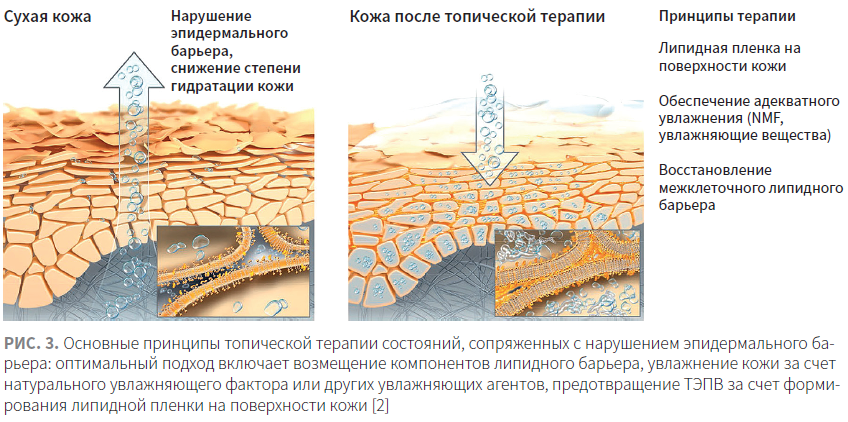
Таким образом, при наличии хронических дерматозов самое пристальное внимание необходимо уделить питанию, особенно если пациент придерживается веганского образа жизни. Из-за невозможности повлиять на генетически обусловленные дефекты эпидермального барьера, свойственные хроническим дерматозам, таким пациентам следует обратить внимание на топическую терапию — специальный косметический уход с акцентом на восстановление эпидермального барьера. В первую очередь он должен включать барьерные липиды и увлажняющие вещества, такие как мочевина, гиалуроновая кислота (рис. 3).
Восстановление эпидермального барьера при помощи уходовых средств
Топические средства, возвращающие роговому слою пластичность и мягкость, называются эмолентами (от англ. emollient — смягчающий). Это понятие объединяет препараты, которые отличаются между собой по составу и механизму действия, однако дают сходный клинический результат — смягчение кожи. С этой целью в рецептуры эмолентов включают липиды, входящие в состав липидного барьера. После нанесения на кожу они быстро проникают в поверхностные слои рогового слоя и встраиваться в межклеточные липидные пласты, восстанавливая их структуру и функционирование [3]. Особенно эффективны липидные смеси, составленные из физиологических* липидов — CER, холестерина и СЖК [22]. (* Физиологическими эти липиды называют потому, что они составляют естественный липидный барьер рогового слоя человека. — Прим. ред.) В недавних исследованиях было показано, что эмоленты, содержащие физиологические липиды, увлажняют роговой слой более эффективно по сравнению с эмолентами на основе вазелина без содержания липидов [23].
CER являются одним из основных компонентов межклеточных липидов рогового слоя. Они играют важную роль в установлении и поддержании влагоудерживающих свойств кожи [24]. Структурно CER состоит из двух молекул: сфингозидного полярного основания и жирной гидрофобной кислоты, соединенных амидной связью (см. рис. 1Д).
Исследования показали, что для поддержания здоровья кожи необходимо достаточное количество эпидермальных CER [25]. В попытке восполнить естественные CER кожи, потерянные из-за различных состояний кожи и старения, и восстановить барьерную функцию были изучены CER, полученные из бычьего мозга и биотехнологических источников. Хотя CER животных выделяют до начала губчатой энцефалопатии крупного рогатого скота, профиль безопасности для косметических и пищевых продуктов еще не установлен [26]. В качестве альтернативы CER были выделены из растений: по своему строению и свойствам они могут быть идентичными эпидермальным CER человека и отличаются удовлетворительным профилем безопасности для косметического и терапевтического применения.
В этой связи средства по уходу за кожей на основе фито-CER могут способствовать увлажнению кожи и восстановлению ее собственного защитного барьера. Пероральная, а также местная доставка фито-CER могут либо усилить эндогенную способность эпидермиса к синтезу липидов [27], либо заменить истощенные CER кожи при некоторых патологических состояниях и при старении [28]. Эти CER естественным образом содержатся в злаковых, клубненосных и бобовых растениях, таких как пшеница, рис, кукуруза, картофель, в том числе сладкий картофель, соя и конжак, а кроме того, могут быть получены путем ферментации.
Согласно клиническим исследованиям, применение уходовых средств на основе CER может смягчить симптомы АД [29–31].
В последнее время предпринимаются усилия по разработке путей эффективной доставки таких ингредиентов, как фито-CER, в кожу, один из них — использование мультивезикулярной эмульсионной системы (multivesicular emulsion; MVE). Технология MVE включает создание двухфазной эмульсионной системы «масло-в-воде», в которой присутствуют концентрические многослойные сферы из масла и воды. Активные ингредиенты могут высвобождаться из соответствующих слоев этих сфер при нанесении на кожу. В сравнении с обычным косметическим средством, в котором доставка активных компонентов происходит «одним всплеском», т.е. однократно, технология MVE обеспечивает постепенную, последовательную доставку активных компонентов в кожу. В дополнение к контролируемому высвобождению активных агентов мультивезикулярная эмульсионная основа помогает улучшить биофизические свойства кожи за счет уменьшения ТЭПВ и усиления гидратации кожи [32].
Фито-CER и технология MVE легли в основу линии уходовых средств CeraVe.
Линия средств CeraVe — топические фитоцерамиды для восстановления эпидермального барьера
Марка CeraVe была разработана совместно с ведущими дерматологами США в 2005 г. Инновационные средства марки CeraVe помогают восстанавливать гидролипидный барьер кожи с помощью комбинации CER и технологии MVE.
В названии марки отражены ключевые особенности всех средств CeraVe. Cera — обозначает комбинацию трех CER (1, 3 и 6-II), Ve — запатентованную технологию последовательного высвобождения активных компонентов MVE, которая обеспечивает пролонгированный эффект.
Помимо CER, в состав линии уходовых средств CeraVe входит ряд других ингредиентов:
- диметикон — помогает снизить ТЭПВ за счет образования окклюзивной пленки;
- гиалуроновая кислота — гигроскопичный полимер, не проникает в роговой слой, поверхностный увлажнитель;
- молочная кислота — α-гидроксикислота, компонент NMF, способствует десквамации корнеоцитов;
- никотинамид — водорастворимый витамин, усиливает синтез свободных жирных кислот и CER в роговом слое, обладает противовоспалительным и себорегулирующим эффектом [33];
- вазелин — окклюзивный пленкообразующий увлажнитель;
- прамоксина гидрохлорид — оказывает противозудное действие;
- ретинол — обеспечивает нормальную дифференциацию эпителиальной ткани, тормозит процессы кератинизации, усиливает пролиферацию эпителиоцитов, омолаживает клеточные популяции и уменьшает количество клеток, которые идут по пути терминальной дифференцировки;
- салициловая кислота — в низкой концентрации оказывает кератопластическое действие, в высокой является кератолитиком; также обладает слабыми антимикробными свойствами и способствует смягчению и отшелушиванию рогового слоя [34];
- мочевина — низкомолекулярное гигроскопичное вещество, проникает в роговой слой, глубокое увлажнение;
- витамин C — антиоксидантное действие, осветление и выравнивание тона кожи;
- диоксид титана — фотопротективное действие;
- оксид цинка — фотопротективное действие.
Все активные компоненты, в том числе CER и гиалуроновая кислота, находятся в многослойных сферах. Эти сферы при попадании на кожу постепенно открываются, последовательно высвобождая активные компоненты, что гарантирует пролонгированный эффект всех средств ухода CeraVe.
Показания к применению уходовых средств CeraVe:
- атопический дерматит;
- псориаз;
- акне;
- ксероз при сахарном диабете;
- ксероз кожи различной этиологии;
- чувствительная кожа.
Линейка увлажняющих средства CeraVe представлена кремом и лосьоном, состав и действие которых схожи. Разница в этих средствах заключается в текстурах: у Увлажняющего лосьона — легкая и нежирная, у Увлажняющего крема — насыщенная текстура.
Использование Увлажняющего крема в монотерапии продемонстрировало значительное уменьшение выраженности основных симптомов АД, таких как сухость, шелушение кожи и зуд. Включение продуктов CeraVe в комплексную терапию АД позволяет сократить продолжительность применения кортикостероидов [30, 31].
Показаниями к назначению Увлажняющего крема и Увлажняющего лосьона являются сухая кожа и ксерозы различной этиологии. Насыщенная текстура Увлажняющего крема более удобна для нанесения на отдельные очаги. Легкая и нежирная текстура Увлажняющего лосьона удобна для нанесения при распространенном кожном процессе.
Заключение
Нарушение целостности эпидермального барьера может иметь генетические причины, как в случае хронических дерматозов, или являться последствием воздействия внешних или внутренних факторов, в том числе образа жизни. Независимо от этиологии нарушений именно эпидермальный барьер следует избрать терапевтической мишенью. Восстановление его структурной и функциональной полноценности снижает ТЭПВ, повышает степень гидратации кожи, позволяет выстроить мощную защиту от проникновения чужеродных веществ и патогенных микроорганизмов.
Специальный косметический уход при помощи средств линии CeraVe, обогащенных комбинацией из трех необходимых CER, позволит восстановить и укрепить естественный липидный барьер кожи, помогая снизить явления ксероза, зуда и воспаления. Уходовые средства CeraVe могут использоваться в рамках ежедневного ухода за кожей для восстановления или поддержания целостности эпидермального барьера при заболеваниях, влияющих на состояние кожи, а также быть частью комплексной терапии хронических дерматозов.
Статья опубликована в журнале «Косметика и медицина Special Edition» №3/2021
На правах рекламы
Литература
- Feingold K.R., Elias P.M. Role of lipids in the formation and maintenance of the cutaneous permeability barrier. Biochim Biophys Acta 2014; 1841(3): 280–294.
- Свирщевская Е.В., Матушевская Е.В. Роль липидов в барьерных свойствах кожи. Клиническая дерматология и венерология 2019; 18(3): 360–365.
- Атопический дерматит и псориаз в практике косметолога. Под общ. ред. Е.И. Эрнандес, А.В. Новицкой. М.: ИД «Косметика и медицина», 2019. («Моя специальность — косметология»).
- Kim J., Kim B.E., Leung D.Y.M. Pathophysiology of atopic dermatitis: Clinical implications. Allergy Asthma Proc 2019; 40(2): 84–92.
- Gorvett Z. How a vegan diet could affect your intelligence. BBC News. 28th January 2020. https://www.bbc.com/future/article/20200127-how-a-vegan-diet-could-affect-your-intelligence.
- Kahleova H., Levin S., Barnard N. Cardio-metabolic benefits of plant-based diets. Nutrients 2017; 9(8): 848.
- Protudjer J.L.P., Mikkelsen A. Veganism and paediatric food allergy: two increasingly prevalent dietary issues that are challenging when co-occurring. BMC Pediatr 2020; 20(1): 341.
- Saunders A.V., Davis B.C., Garg M.L. Omega-3 polyunsaturated fatty acids and vegetarian diets. Med J Aust 2013; 199(S4): S22–S26.
- McCusker M.M., Grant-Kels J.M. Healing fats of the skin: the structural and immunologic roles of the omega-6 and omega-3 fatty acids. Clin Dermatol 2010; 28(4): 440–551.
- Czarnowicki T., Krueger J.G., Guttman-Yassky E. Novel concepts of prevention and treatment of atopic dermatitis through barrier and immune manipulations with implications for the atopic march. J Allergy Clinical Immunol 2017; 139(6): 1723–1734.
- Augustin M., Wilsmann-Theis D., Körber A., et al. Positionspapier: Diagnostik und Therapie der Xerosis cutis. J Dtsch Dermatol Ges 2018; 16(Suppl 4): 3–35.
- Kim J.E., Kim H.S. Microbiome of the Skin and Gut in Atopic Dermatitis (AD): Understanding the Pathophysiology and Finding Novel Management Strategies. J Clin Med 2019; 8(4): 444.
- Grän F., Kerstan A., Serfling E., et al. Current Developments in the Immunology of Psoriasis. Yale J Biol Med 2020; 93(1): 97–110.
- Silverberg J.I., Lee-Wong M., Silverberg N.B. Complementary and alternative medicines and childhood eczema: a US population-based study. Dermatitis 2014; 25(5): 246–254.
- Sampson H.A., Aceves S., Bock S.A., et al. Food allergy: a practice parameter update-2014. J Allergy Clin Immunol 2014; 134(5): 1016–1025.e43.
- Caubet J.C., Szajewska H., Shamir R., Nowak-Wegrzyn A. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol 2017; 28(1): 6–17.
- Nowak-Wegrzyn A., Katz Y., Mehr S.S., Koletzko S. Non-IgE-mediated gastrointestinal food allergy. J Allergy Clin Immunol 2015; 135(5): 1114–1124.
- Sova C., Feuling M.B., Baumler M., et al. Systematic review of nutrient intake and growth in children with multiple IgE-mediated food allergies. Nutr Clin Pract 2013; 28(6): 669–675.
- Suskind D.L. Nutritional deficiencies during normal growth. Pediatr Clin N Am 2009; 56(5): 1035–1053.
- Sicherer S.H., Sampson H.A. Food allergy: a review and update on epidemiology, pathogenesis, diagnosis, prevention, and management. J Allergy Clin Immunol 2018; 141(1): 41–58.
- Jacobs D.R. Jr., Haddad E.H., Lanou A.J., Messina M.J. Food, plant food, and vegetarian diets in the US dietary guidelines: conclusions of an expert panel. Am J Clin Nutr 2009; 89(5): 1549S–1552S.
- Mutanu Jungersted J., Hellgren L.I., Høgh J.K., et al. Ceramides and barrier function in healthy skin. Acta Derm Venereol 2010; 90(4): 350–353.
- Danby S.G., Andrew P.V., Brown K., et al. An investigation of the skin barrier restoring effects of a cream and lotion containing ceramides in a multivesicular emulsion in people with dry, eczema-prone skin: the RESTORE Study Phase 1. Dermatol Ther 2020; 10(5): 1031–1041.
- Menon G.K., Cleary G.W., Lane M.E. The structure and function of the stratum corneum. Int J Pharm 2012; 435(1): 3–9.
- McCusker M.M., Grant-Kels J.M. Healing fats of the skin: the structural and immunologic roles of the omega-6 and omega-3 fatty acids. Clin Dermatol 2010; 28(4): 440–551.
- Ono J., Kinoshita M., Aida K., et al. Effects of dietary glucosylceramide on dermatitis in atopic dermatitis model mice. Eur J Lipid Sci Tech 2010; 112(7): 708–711.
- Shimoda H., Terazawa S., Hitoe S., et al. Changes in ceramides and glucosylceramides in mouse skin and human epidermal equivalents by rice-derived glucosylceramide. J Med Food 2012; 15(12): 1064–1072.
- Ueda O., Hasegawa M., Kitamura S. Distribution in skin of ceramide after oral administration to rats. Drug Metab Pharmacokinet 2009; 24(2): 180–184.
- Kircik L., Hougeir F., Bikowski J. Atopic dermatitis, and the role for a ceramide-dominant, physiologic lipid-based barrier repair emulsion. J Drugs Dermatol 2013; 12(9): 1024–1027.
- Lynde C.W., Andriessen A. A cohort study on a ceramide-containing cleanser and moisturizer used for atopic dermatitis. Cutis 2014; 93(4): 207–213.
- Draelos Z.D. The effect of ceramide-containing skin care products on eczema resolution duration. 2008; 81(1): 87–91.
- Bikowski J., Shroot B. Multivesicular emulsion: a novel, controlled-release delivery system for topical dermatological agents. J Drugs Dermatol 2006; 5(10): 942–946.
- Wohlrab J., Kreft D. Niacinamide — mechanisms of action and its topical use in dermatology. Skin Pharmacol Physiol 2014; 27(6): 311–315.
- Arif T. Salicylic acid as a peeling agent: a comprehensive review. Clin Cosmet Investig Dermatol 2015; 8: 455–461.