Morpheus8V: МАЛОИНВАЗИВНАЯ КОРРЕКЦИЯ АТРОФИЧЕСКИХ ИЗМЕНЕНИЙ ВЛАГАЛИЩА И УРОЛОГИЧЕСКОЙ ДИСФУНКЦИИ В ПОСТМЕНОПАУЗЕ
25.09.2024
Erid: 2RanykiJTtt
Лешунов Евгений Викторович
Врач пластический хирург, уролог.
Аспирант кафедры урологии и хирургической андрологии РМАНПО.
Научный руководитель Евро-Азиатской Ассоциации Специалистов Эстетической Медицины.
Член правления ISRAIT (Международного общества реконструктивной и эстетической интимной хирургии).
Сертифицированный тренер компании INMODE. Москва, клиника «Госпиталь мира»
Для многих женщин вступление в период менопаузы знаменует начало нового жизненного этапа. Менопауза — стойкое физиологическое прекращение менструаций на срок более 12 мес вследствие дефицита эстрогенов, не связанного с какой-либо патологией. Средний возраст наступления менопаузы составляет 51 год, что также подвержено этническим и региональным вариациям. В ряде случаев менопауза может наступить раньше — как естественным образом, так и в результате хирургического вмешательства, лучевой или химиотерапии [1]. Учитывая увеличение продолжительности жизни, можно утверждать, что продолжительность постменопаузального периода составляет около 40% жизни женщины [2]. Согласно расчетам ВОЗ, в 2030 г. количество женщин в постменопаузе будет насчитывать порядка 1,2 млрд [1].
Дефицит половых гормонов, характерный для данного периода, является генетически детерминированным и влечет за собой выраженные изменения мочеполовой системы [3].
Благодаря общему эмбриональному происхождению как нижние мочевыводящие пути, так и половые органы имеют эстрогеновые рецепторы, трофика и физиология которых зависит от уровня эстрогенов [4]. Менопаузальная гипоэстрогения служит причиной структурно-функциональных изменений половых и мочевыводящих путей.
Снижение уровня эстрогенов приводит к нарушению созревания плоского эпителия с увеличением доли базальных и промежуточных клеток и уменьшением числа поверхностных клеток. Вследствие нарушения созревания эпителия влагалища происходит снижение его эластичности, ригидность и наличие петехий.
Гипоэстрогения также вызывает изменение соотношения фибрилл коллагена I типа к фибриллам коллагена III типа с потерей их трабекулярного расположения, уменьшение количества эластиновых волокон, снижение васкуляризации, истончение и уплощение эпителия влагалища, который может поверхностно превращаться в кератинизированный слой [5]. Многослойный плоский эпителий влагалища и уретры становится бледным и тонким, выработка гликогена снижается, происходит повышение pH поверхности слизистой оболочки. Изменение условий микросреды мочеполовых путей приводит к трансформации микробиома: число лактобацилл снижается, увеличивается доля кишечных бактерий [6].
Снижение васкуляризации, деградация коллагеновых и эластиновых волокон, дефицит гиалуроновой кислоты приводят к стойким изменениям влагалища, вульвы, мочевого пузыря и уретры (рис. 1) [7].
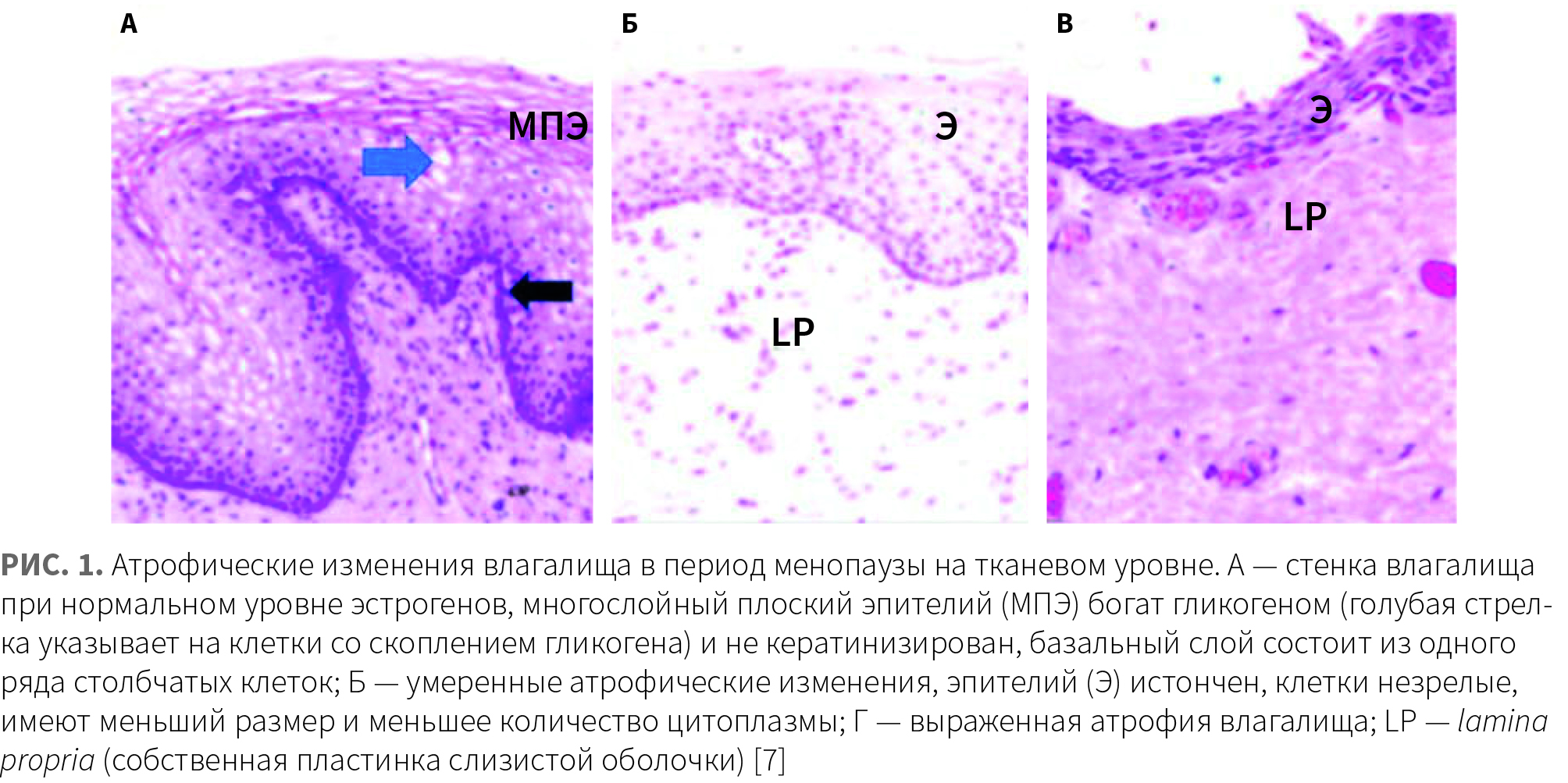
Влагалище становится суженным и укороченным, теряет извилистость и эластичность. Подкожно-жировая клетчатка вульвы уменьшается, кожа и слизистая оболочка становятся более тонкими и дряблыми [7]. Наблюдается прогрессирующая утрата тонуса и трофики уретры и мочепузырного треугольника. Показатели давления закрытия уретры, давления в точке утечки Вальсальвы и порог чувствительности мочевого пузыря при растяжении также снижаются [4].
Комплекс симптомов и признаков, обусловленных клиническими, анатомическими и гистологическими изменениями в половых органах и мочевыводящих путях вследствие снижения уровня гормонов яичников, обозначается термином «мочеполовой синдром менопаузы» (МСМ) [4].
Мочеполовой синдром менопаузы как терапевтическая мишень
МСМ — это хроническое прогрессирующее заболевание вульвовагинальной области и нижних мочевых путей, которое характеризуется широким спектром признаков и симптомов. Клинические проявления заболевания обобщены в табл. 1 [8, 9].
Таблица 1. Проявления мочеполового синдрома менопаузы
|
Гинекологические |
Сексуальная дисфункция |
Урологические |
|
|
|
Симптомы МСМ встречаются у 50–70% женщин в постменопаузальный период [9]. Наиболее остро мочеполовые нарушения проявляются в первые постменопаузальные годы, негативно влияя на качество жизни и самочувствие [10].
Терапевтические методы первой линии включают различные негормональные средства, такие как вагинальные лубриканты и увлажнители. Лубриканты — это средства на водной, силиконовой или масляной основе, которые не впитываются в кожу. Они действуют мгновенно и обеспечивают временное облегчение сухости влагалища и боли во время интимной близости; поэтому они действительно полезны для женщин, у которых сухость влагалища является проблемой только или преимущественно во время полового акта. Вагинальные увлажняющие средства применяются регулярно. Они являются биоадгезивами и способны улучшить коитальный комфорт и повысить увлажненность влагалища. Увлажняющие средства имитируют вагинальный секрет и снижают рН, изменяя содержание жидкости в вагинальном эпителии. Однако оба эти типа средств подходят в основном для женщин с легкими и умеренными симптомами МСМ, и многим пациентам в конечном итоге потребуются дополнительные гормональные препараты, направленные на коррекцию гипоэстрогении [2].
Местные эстрогены являются наиболее эффективным средством, способным обратить вспять старение мочеполовой системы и уменьшить выраженность проявлений МСМ [11], они способствуют устранению недержания мочи за счет увеличения давления закрытия уретры и индукции плоскоклеточной метаплазии переходного эпителия нижних отделов мочеиспускательного канала. Исходя из этого, местные низкодозированные эстрогены считаются терапевтическим «золотым стандартом» в случаях легких и умеренных проявлений МСМ при неэффективности лубрикантов и увлажняющих средств, а также в случаях недержания мочи [12].
Однако применение эстрогенов не всегда возможно из-за повышенного риска нежелательных явлений и осложнений, включая болезненность молочных желез, вагинальные кровотечения, метеоризм и перепады настроения, а также противопоказано женщинам с ишемической болезнью сердца, хронической венозной недостаточностью, перенесенным инсультом, заболеваниями печени, вагинальными кровотечениями и онкогинекологическими заболеваниями.
В случаях, когда в анамнезе имеются эстрогенчувствительные опухоли, такие как рак молочной железы или эндометрия, любая гормональная терапия должна применяться с осторожностью [9].
В связи с этим высокой востребованностью пользуются альтернативные подходы к коррекции мочеполовых нарушений (рис. 2) [4].
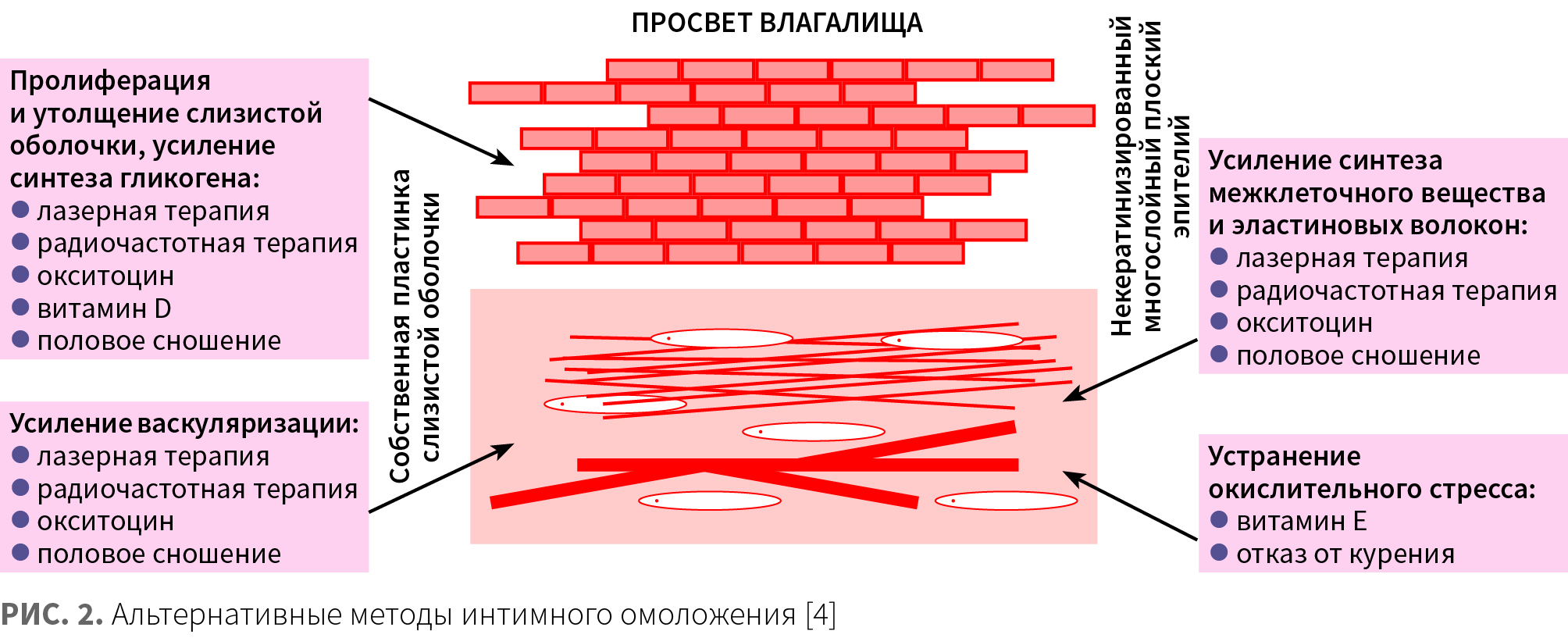
Согласно исследованиям последних лет, высокоэнергетические аппаратные методы зарекомендовала себя в качестве эффективного и безопасного метода коррекции проявлений МСМ. Целью их применения являются сокращение мягких тканей и стимуляция неоколлагеногенеза и неоангиогенеза.
Физические основы воздействия радиочастотного тока на ткани урогенитальной области
Последние 15 лет стали периодом стремительного развития и совершенствования применения радиочастотной технологии в эстетической медицине.
Радиочастотная энергия (radiofrequency; RF) — это переменный ток радиочастотного диапазона, показатель частоты которого зависит от области применения и цели. Наиболее распространенная частота переменного электрического тока медицинского оборудования составляет 1 млн Гц. Главный терапевтический эффект радиочастотного воздействия заключается в прицельном нагреве тканей-мишеней. Это становится возможным благодаря разной электропроводности тканей [13].
При прохождении через ткани (например, кожу, мышцы) ток встречает сопротивление с их стороны (импеданс) и вызывает микроосцилляции (колебательные движения) молекул. Микроосцилляции приводят к нагреву тканей согласно закону Ома: J = I2 × R × T, где J — термическая энергия, I — сила тока, R — импеданс ткани, T — продолжительность воздействия. Например, коллаген имеет более высокий импеданс по сравнению с мышечными волокнами, поэтому при прохождении переменного тока нагревается сильнее. В свою очередь, при прохождении RF-тока подкожно-жировой слой нагревается в 7 раз сильнее, чем дерма, что приводит к некрозу жировой ткани при сохранении эпидермиса от термического повреждения [14].
Путем изменения конфигурации и размера электродов можно управлять плотностью потока энергии и, как следствие, модулировать желаемые эффекты. Существует несколько различных традиционных конфигураций электродов, применяемых в эстетической медицине, к основным из них можно отнести монополярные и биполярные устройства.
Монополярные устройства представляют собой один RF-генератор, один электрод и одну пластину заземления с отрицательным зарядом. Электрод накладывается на внутренние или внешние мягкие ткани, а возвратный электрод в форме заземляющей площадки помещается на отдалении от зоны коррекции. Энергия протекает от положительного электрода к отрицательно заряженной пластине заземления и, так как она находится на значительном расстоянии от манипулы, сильно рассеивается. Поэтому для воздействия на глубокие слои кожи такому аппарату необходимо иметь большую мощность энергии, что может вызвать ожог поверхностного слоя кожи, с целью предотвращения которого необходимости применять эффективное охлаждение. К достоинствам можно отнести лишь высокую эффективность процедур [15].
Второе поколение RF-устройств — биполярные системы. Они имеют один RF-генератор и два электрода — положительно заряженный и отрицательно заряженный. Радиочастотный ток проходит через ткань только по дуге между электродами, не воздействуя на нецелевые органы и ткани. Модификацией биполярной RF-технологии служат микроигольчатые RF-устройства.
Положительно заряженные электроды представляют собой микроиглы, которые вводятся в ткани на заданную глубину. Отрицательные электроды располагаются на поверхности кожи по обе стороны аппликатора и не прилегают к положительно заряженным микроиглам. Эта конструктивная особенность обеспечивает биполярное RF-воздействие «снаружи внутрь». RF-ток испускается с кончика игольчатого электрода и течет вверх к поверхностному возвратному электроду. В тканях при этом формируются три зоны термического повреждения — зона абляции, зона обратимой коагуляции, а также большая зона некоагуляционного, неаблятивного нагрева ткани (рис. 3). Благодаря фракционному характеру воздействия колонны термически поврежденной ткани равноудалены друг от друга и чередуются с интактными зонами, что позволяет ускорить регенерацию [13].
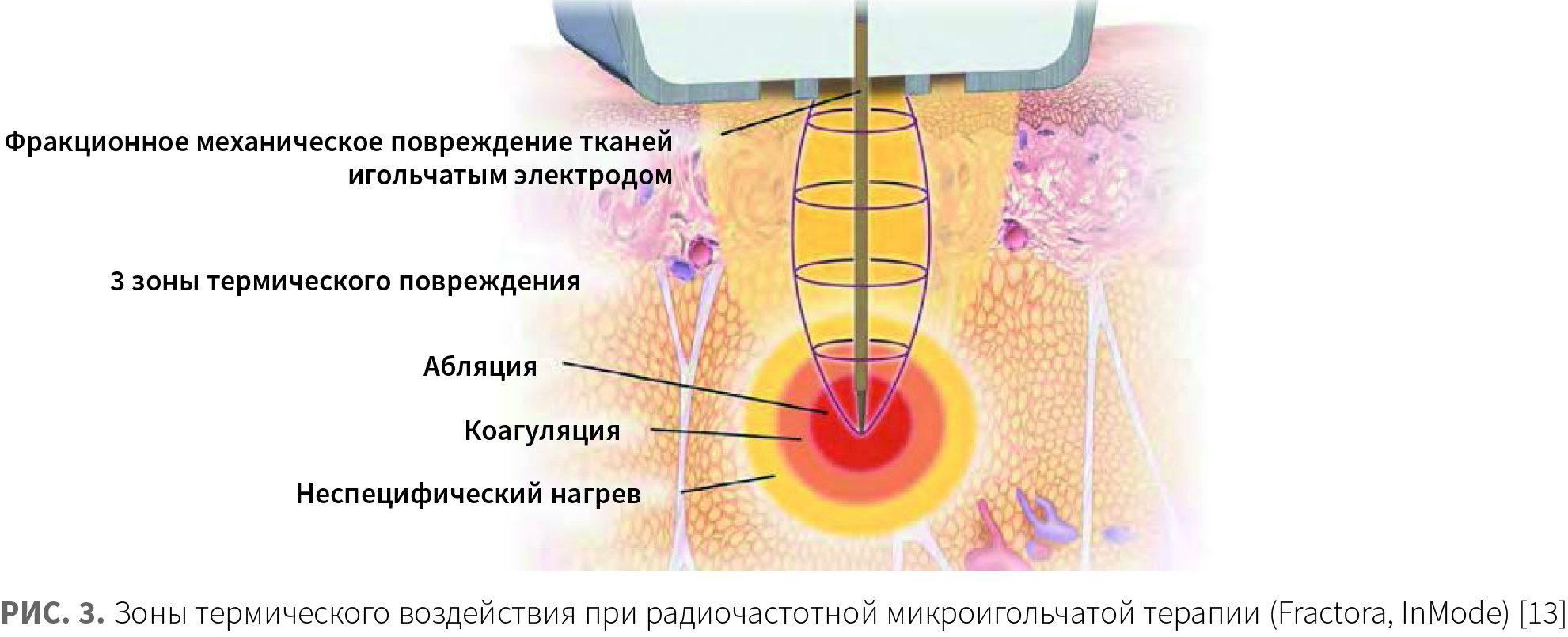
Фракционное термическое повреждение эффективно применяется для ремоделирования слизистой оболочки и кожи вульвовагинальной области.
Клинический опыт применения микроигольчатой RF-терапии для коррекции симптомов МСМ
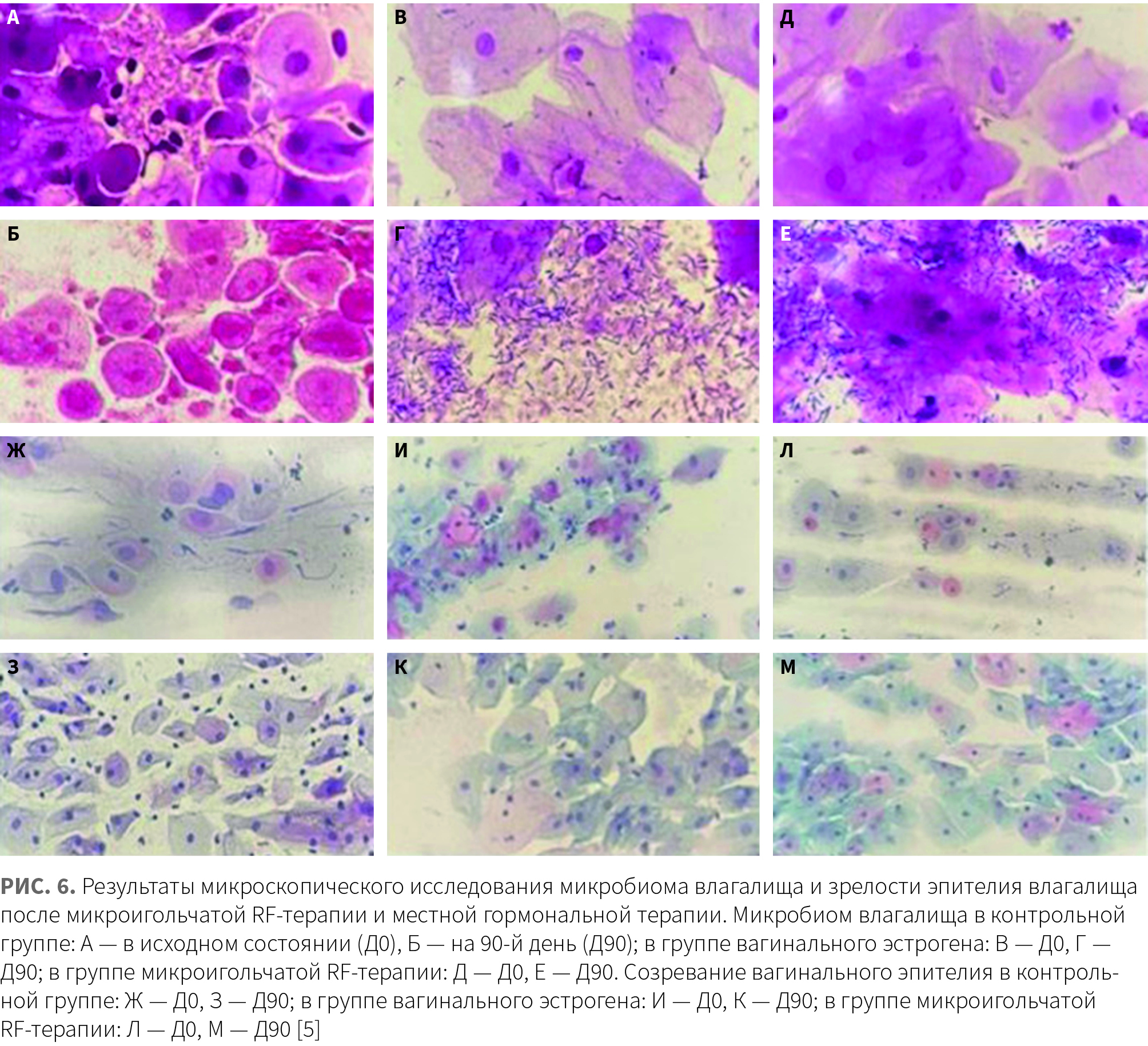
Изменения структурно-функционального состояния и микробиома вульвовагинальной области после микроигольчатой RF-обработки были оценены Sarmento A.C. и соавт. [16]. В исследовании приняли участие 55 женщин в возрасте 55–65 лет, у которых последняя менструация была не менее чем за 12 мес до начала исследования. Критериями включения также являлись диагноз МСМ, наличие половой жизни, уровень гонадотропина и эстрадиола в плазме крови в постменопаузальном диапазоне (ФСГ > 40 Ед/л; эстрадиол < 25 пг/мл) и отрицательные результаты мазка Папаниколау (PAP) на клетки-предшественники рака шейки матки. Для проведения микроигольчатой RF-терапии использовался аппликатор с 24 игольчатыми электродами диаметром 200 мкм и длиной 1 мм. За 3 мин до процедуры на область преддверия влагалища и слизистую оболочку входа во влагалище наносили 10% спрей лидокаина. Курс терапии включал 3 процедуры микроигольчатой RF-обработки с интервалом в 30 дней. Было взято 6 мазков из влагалища для определения степени созревания клеток и состава микробиома влагалища.
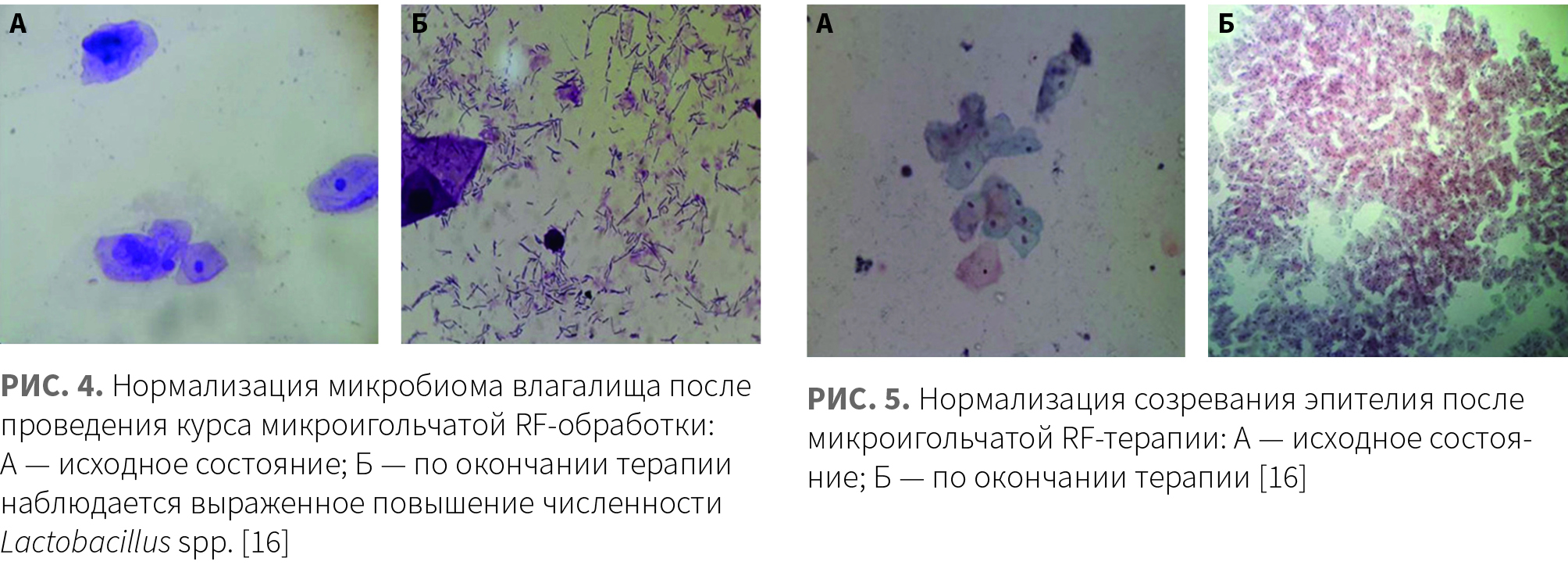
После окончания курса микроигольчатой RF-терапии наблюдались уменьшение выраженности проявлений МСМ и нормализация состава микробиома:
- увеличение доли Lactobacillus spp. до 85% у 61% пациентов (в исходном состоянии Lactobacillus spp. составляли 85% микробиома лишь у 15% пациентов) (рис. 4);
- прогрессирующее снижение рН влагалища с 5,6 в исходном состоянии до 4,3 по окончании терапии (−1,3);
- снижение доли парабазальных клеток и увеличение доли поверхностных клеток (рис. 5);
- повышение индекса вагинального здоровья (Vaginal Health Index; VHI) с 13,2 в исходном состоянии до 22,5 по окончании терапии (+9,33).
В более позднем исследовании те же авторы сопоставили эффективность фракционной радиочастотной терапии и гормональной терапии при постменопаузальной вульвовагинальной атрофии в ходе рандомизированного сравнительного исследования. В состав выборки были включены 120 женщины в постменопаузе (возраст от 55 до 65 лет), ведущие половую жизнь, с вульвовагинальной атрофией (VHI ≤ 15). Участницы были разделены на три группы:
- группа 1 (n = 40) — микроигольчатая RF-терапия;
- группа 2 (n = 40) — гормональная терапия;
- группа 3 (n = 40) являлась контрольной, лечение не проводилось.
Для микроигольчатой RF-обработки использовался аппликатор с 24 игольчатыми электродами диаметром 200 мкм и длиной 1 мм. Было проведено 3 процедуры микроигольчатой RF-обработки с интервалом в 30 дней.
Пациентки из группы 2 наносили 1 г вагинального крема на основе эстрадиол-3-пропил-17β-метилдиэтилового эфира 2 раза/нед в течение 3 мес.
Женщины из контрольной группы посещали врача в течение периода наблюдения и следовали общим рекомендациям по базовому интимному уходу при наличии проявлений МСМ.
На 90-й день авторы отметили сопоставимые улучшения интимного здоровья женщин в обеих терапевтических группах (микроигольчатой RF-терапии и гормональной терапии) без статистически значимых межгрупповых различий:
- повышение индекса сексуальной функции женщин (Female Sexual Function Index; FSFI);
- повышение VHI, улучшение показателей влажности влагалища, объема жидкости, pH, эластичности и целостности;
- нормализацию микробиома влагалища с повышением доли Lactobacillus;
- нормализацию созревания эпителия влагалища (рис. 6).
- Пациентки быстро восстановились после микроигольчатой RF-терапии, а последствия микроабляции (жжение, покраснение, раздражение, боль во влагалище) исчезли через 3–5 дней после процедуры. В группе гормональной терапии 5 пациенток предъявляли жалобы на выделения из влагалища.
Campos M.L. и соавт. сравнили результаты коррекции проявлений МСМ умеренной и тяжелой степени при помощи CO2-лазера, RF-микроигольчатой терапии или топической гормональной терапии [17]. По клиническим и гистологическим критериям оценки эффективности и безопасности CO2-лазер и микроигольчатая RF-терапия не уступали местной гормональной терапии, являющейся в настоящее время «золотым стандартом» лечения МСМ [14].
Согласно выводам авторов, микроигольчатая RF-терапия является эффективным методом коррекции проявлений постменопаузальной вульвовагинальной атрофии и не уступает по переносимости и эффективности гормональной заместительной терапии.
Микроигольчатая RF-абляция также может использоваться для устранения проявлений гиперактивного мочевого пузыря — урологического синдрома, характеризующегося частыми позывами к мочеиспусканию в сочетании с недержанием мочи и никтурией. Вегетативные нервы и ганглии, влияющие на чувствительность и контроль мочевого пузыря, расположены ниже проксимальной уретры и мочепузырного треугольника. Трансвагинальная радиочастотная абляция позволяет успешно денервировать эту область, что сопровождается уменьшением выраженности симптомов гиперактивного мочевого пузыря [18].
Ghoniem G. и соавт. оценили эффективность применения микроигольчатой RF-абляции при гиперактивном мочевом пузыре. В исследовании приняла участие 31 женщина с гиперактивным мочевым пузырем и смешанным недержанием мочи. Пациентам была проведена процедура трансвагинальной RF-абляции иннервирующих детрузор нервных волокон на глубине 7 мм (рис. 7). (Детрузор мочевого пузыря (от лат. detrudere — выталкивать) — мышечная оболочка (tunica muscularis) органа, состоящая из трех взаимно переплетающихся слоев, образующих единую мышцу, изгоняющую мочу (m. detrusor urinae). — Прим. ред.)
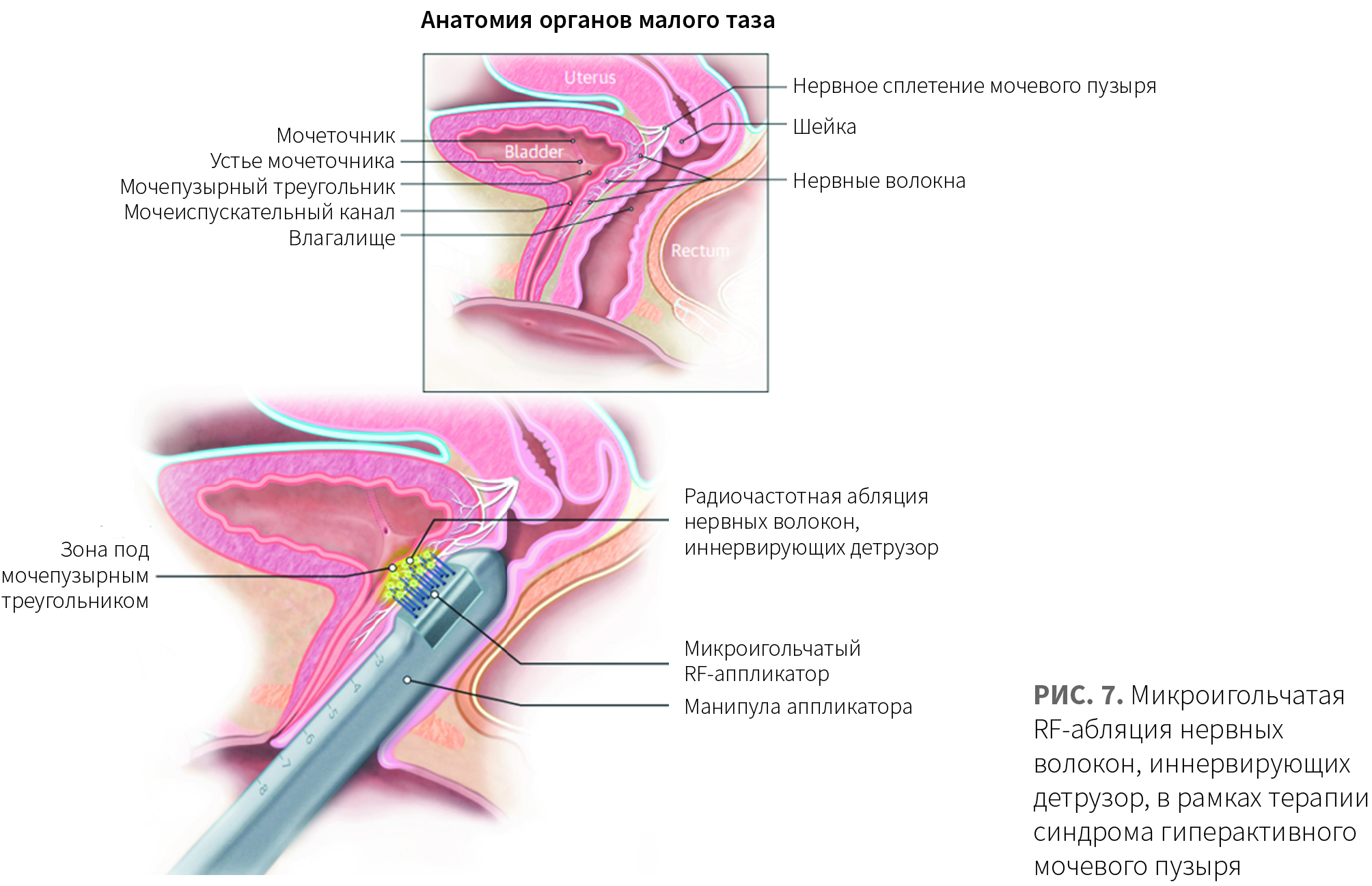
Для оценки эффективности метода использовались:
- показатель количества эпизодов недержания мочи;
- опросник «Влияние недержания мочи на качество жизни 7» (Incontinence Impact QurstionnaireI; IIQ-7);
- шкала урогенитального дистресса 6 (UDI-6);
- опросник «Восприятие пациентом выраженности дисфункции мочевого пузыря» (Patient’s Perception of BladderCondition; PPBC);
- оценка боли сразу после процедуры;
- общая оценка пациентом выраженности улучшений.
По всем показателям, за исключением случайных подтеканий при смешанном недержании мочи, трансвагинальная радиочастотная абляция продемонстрировала себя в качестве эффективного метода коррекции синдрома гиперактивного мочевого пузыря (табл. 2).
Таблица 2. Выраженность проявлений синдрома гиперактивного мочевого пузыря через 1 и 3 мес после процедуры трансвагинальной RF-абляции иннервирующих детрузор нервных волокон
|
Показатель |
Исходный |
1 мес |
3 мес |
|
IIQ |
55,15 |
19,64 |
19,87 |
|
UDI |
53,33 |
15,38 |
17,52 |
|
PPBC |
4,41 |
0,85 |
0,89 |
|
Частота мочеиспусканий |
28,96 |
20,92 |
22 |
|
Ургентное недержание (по пути в туалет) |
7,04 |
0 |
0,12 |
|
Случайные подтекания |
5,43 |
3,35 |
3,54 |
|
Ургентное недержание (общий показатель) |
12,46 |
3,35 |
3,65 |
|
Тяжелая степень недержания |
2,93 |
0,28 |
0,35 |
Что касается общей оценки пациентом выраженности улучшений, через 3 мес после процедуры 11,1% пациентов отметили отсутствие улучшений, 40,7% — умеренные улучшения, 48,1% — выраженные улучшения.
Радиочастотная коррекция мочеполовых нарушений при помощи Morpheus8V
Компания InMode разработала специализированный эндовагинальный аппликатор MorpheusV для коррекции проявлений МСМ. Mopheus8V обеспечивает вертикальное и горизонтальное фракционное радиочастотное аблятивное повреждение слизистой оболочки влагалища и подслизистой мышечной пластинки. 24 микроиглы с золотым покрытием направлены по окружности в слизистую оболочку и подслизистые ткани влагалища. Пользователь может осуществлять обработку на 360°, контролируя глубину высвобождения фракционной радиочастотной аблятивной энергии (1–3 мм).
Morpheus8 — высокотехнологичное устройство, оснащенное автоматической системой безопасности. Встроенные датчики осуществляют оценку изменений контакта и сопротивление тканей 1000 раз в секунду, чтобы отрегулировать подачу RF-тока на игольчатые электроды. Это позволяет минимизировать риск чрезмерного термического повреждения.
Контролируемое повреждение стимулирует ремоделирование слизистой оболочки и стенки влагалища в процессе заживления, что будет способствовать устранению симптомов МСМ / атрофического вагинита.
После обработки Morpheus8V в течение нескольких дней будут наблюдаться некоторые выделения, вслед за которыми наступит период возвращения сухости влагалища продолжительностью в несколько недель. Через 6 нед начнется регресс симптомов и признаков вульвовагинальной атрофии. Большинство пациентов с МСМ / вагинальной атрофией сообщают об ослаблении симптомов МСМ на 70–85% [13].
При отсутствии поддерживающей терапии после обработки Morpheus8V в результате дефицита эстрогенов произойдет постепенное возобновление клиники атрофии влагалища/вульвы, поэтому рекомендуется осуществлять поддерживающие процедуры.
Клинические исследования эффективности Morpheus8V
Эффективность Morpheus8V подтверждена результатами клинических исследований.
Rothenberger R. и соавт. оценили безопасность и эффективность микроигольчатой RF-абляции вагинального канала с целью уменьшения симптомов МСМ и дисфункции мочевого пузыря [19].
Авторы провели многоцентровую проспективную серию исследований, в которой приняли участие 71 женщина с МСМ. Участницы прошли 3 процедуры микроигольчатой RF-терапии с интервалом в 4 нед с помощью аппликатора Morpheus8V. В ходе процедуры осуществлялась полная обработка вагинального канала на глубине 1, 2 и 3 мм. Оценка результатов осуществлялась через 3 и 6 мес после завершающей процедуры с использованием шкалы VHI, визуальной аналоговой шкалы (VAS), а также шкалы урогенитального дистресса 6 (Urogenital Distress inventory-6; UDI-6), а также FSFI (табл. 3).
Таблица 3. Уменьшение выраженности проявлений МСМ после курса микроигольчатой RF-терапии Morpheus8V [18]
|
Показатель |
Исходное состояние |
3 мес |
6 мес |
|
VHI |
15,16 |
19,82 |
20,37 |
|
UDI-6 |
39,58 |
22,50 |
22,42 |
|
FSFI |
18,81 |
22,6 |
22,81 |
До начала курса микроигольчатой RF-терапии аномальные показатели UDI-6 (≥ 33,33) наблюдались у 67% пациентов, через 6 мес — только 26%. Аналогичным образом в исходном состоянии 70% пациентов имели сексуальную дисфункцию по шкале FSFI (≥ 26), через 6 мес — только 48% пациентов.
Процедура микроигольчатой RF-абляции характеризовалась хорошей переносимостью и безопасностью. В ходе обработки отмечался низкий показатель выраженности боли по шкале VAS со средними значениями 2,13, 2,55 и 2,18 при глубине пенетрации 1, 2 и 3 мм соответственно. Нежелательных явлений и осложнений зафиксировано не было.
Согласно выводам авторов, микроигольчатая RF-абляция до 3 мм является эффективным методом коррекции проявлений МСМ. Достигнутые улучшения сохраняются как минимум 6 мес. Дополнительным преимуществом может быть значимый регресс дисфункции мочевого пузыря по шкале UDI-6 и сексуальной дисфункции по шкале FSFI.
Аспект влияния микроигольчатой RF-терапии Morpheus8V на выраженность урологических проявлений МСМ в виде стрессового и смешанного недержания мочи был изучен Abdelaziz A. и соавт [20].
Двадцати женщинам с симптомами недержания мочи в рамках МСМ была проведена одна процедура эндовагинальной микроигольчатой RF-терапии (EmpowerRF, Morpheus8V, InMode). Обработка осуществлялась на глубине 1, 2 и 3 мм. Эффективность оценивалась с помощью стресс-теста «кашель», опросников урологической дисфункции (MESA SI, MESA UI, iQoL, UDI-6) и оценки состояния тканей влагалища по шкале VHI через 1, 3 и 6 мес после процедуры по сравнению с исходным уровнем. Отмечалось уменьшение выраженности урологических проявлений МСМ — никтурии, ургентного и стрессового недержания мочи, учащенного мочеиспускания, а также атрофических изменений влагалища на 1, 3 и 6-м мес периода наблюдения по сравнению с исходным уровнем.
Полученные результаты свидетельствуют о том, что эндовагинальная фракционная RF-терапия при помощи аппликатора Morpheus8V хорошо переносится и обеспечивает выраженный регресс атрофических изменений влагалища и урологических нарушений, характерных для постменопаузы.
Заключение
Появление высокоэнергетических устройств обеспечило новые возможности малоинвазивной коррекции возрастных изменений и эстетических дефектов, в том числе урогенитальной области. Малоинвазивные аппаратные методы обеспечивают выраженный результат, более безопасны и не требуют длительного восстановительного периода, что является значимым преимуществом над эстетической хирургией.
Хотя микроигольчатая RF-терапия не может повлиять на уровень половых гормонов, она служит одним из способов воздействия на звенья патогенеза атрофических изменений влагалища и урологических нарушений в период постменопаузы. Контролируемое повреждение посредством радиочастотного тока стимулирует ремоделирование тканей влагалища в процессе заживления, что способствует устранению симптомов МСМ.
Эндовагинальная микроигольчатая RF-терапия обеспечивает комплексные структурно-функциональные улучшения:
- утолщение некератинизированного эпителия;
- местное усиление ангиогенеза;
- улучшение лубрикации и увлажненности слизистой оболочки влагалища;
- нормализацию микробиома мочеполовых органов;
- снижение рН влагалища;
- запуск неоколлагеногенеза и неоэластогенеза, улучшение эластичности и упругости тканей влагалища, снижение частоты микротравм;
- регресс урологических нарушений [21].
Согласно результатам рассмотренных исследований, микроигольчатая RF-терапия может рассматриваться в качестве альтернативного подхода к коррекции возрастных изменений мочеполовой системы.
Для проведения микроигольчатой RF-терапии можно рекомендовать специализированный эндовагинальный аппликатор Morpheus8V. Устройство обладает высокотехнологичной встроенной системой безопасности и позволяет осуществлять контролируемое термическое повреждение на заданной глубине тканей с минимальным риском нежелательных явлений и осложнений.
Литература
- Pop A.L., Nasui B.A., Bors R.G., et al. The Current Strategy in Hormonal and Non-Hormonal Therapies in Menopause-A Comprehensive Review. Life (Basel) 2023; 13(3): 649.
- Nappi R.E., Martella S., Albani F., et al. Hyaluronic Acid: A Valid Therapeutic Option for Early Management of Genitourinary Syndrome of Menopause in Cancer Survivors? Healthcare (Basel) 2022; 10(8): 1528.
- Jin Z., Tian C., Kang M., et al. The 100 top-cited articles in menopausal syndrome: a bibliometric analysis. Reprod Health 2024; 21(1): 47.
- Garzon S., Apostolopoulos V., Stojanovska L., et al. Non-oestrogenic modalities to reverse urogenital aging. Prz Menopauzalny. 2021; 20(3): 140–147.
- Sarmento A.C.A., Fernandes F.S, Maia R.R., et al. Microablative fractional radiofrequency for sexual dysfunction and vaginal Trophism: A randomized clinical trial. Clinics (Sao Paulo) 2023; 78: 100293.
- Lüthje P., Hirschberg A.L., Brauner A. Estrogenic action on innate defense mechanisms in the urinary tract. Maturitas 2014; 77(1): 32–36.
- Tadir Y., Gaspar A., Lev-Sagie A., et al. Light and energy based therapeutics for genitourinary syndrome of menopause: Consensus and controversies. Lasers Surg Med 2017; 49(2): 137–159.
- Robinson D., Toozs-Hobson P., Cardozo L. The effect of hormones on the lower urinary tract. Menopause Int 2013; 19(4): 155–162.
- Angelou K., Grigoriadis T., Diakosavvas M., et al. The Genitourinary Syndrome of Menopause: An Overview of the Recent Data. Cureus 2020; 12(4): e7586.
- Moral E., Delgado J.L., Carmona F., et al. Genitourinary syndrome of menopause. Prevalence and quality of life in Spanish postmenopausal women. The GENISSE study. Climacteric 2018; 21(2): 167–173.
- Lethaby A., Ayeleke R.O., Roberts H. Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev 2016; 2016(8): CD001500.
- Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society. Menopause 2013; 20(9): 888–902; quiz 903–904.
- Mulholland S. The InMode Book. 2021.
- Dayan E., Burns A., Rohrich R., et al. The use of radio- frequency in aesthetic surgery. Plast Reconstr Surg Glob Open 2020; 8(8): e2861.
- Dayan E., Theodorou S. Not all radiofrequency de- vices are created equal: a thermal assessment. Plast Reconstr Surg Glob Open 2022; 10(2): e4077.
- Sarmento A.C., Fernandes F.S., Marconi C., et al. Impact of microablative fractional radiofrequency on the vaginal health, microbiota, and cellularity of postmenopausal women. Clinics (Sao Paulo) 2020; 75: e1750.
- Campos M.L.P., Bianchi-Ferraro A.M.H.M., de Oliveira C.D., et al. Fractional CO2 Laser, Radiofrequency and Topical Estrogen for Treating Genitourinary Syndrome of Menopause: A Pilot Study Evaluating the Vulvar Vestibule. Medicina (Kaunas) 2023; 60(1): 80.
- Ghoniem G., Mao R., Csuka D.A., et al. Detrusor nerve radiofrequency ablation (DENERA): Experimental study of safety and efficacy in an ovine model. Neurourol Urodyn 2024; 43(2): 527–532.
- Rothenberger R., Karram M. MorpheusV radiofrequency microneedling of the vaginal canal for genitourinary syndrome of menopause. Am J Obstet Gynecol 2024; 230(4): 1195–1196.
- Abdelaziz A., Blusewicz T.A., Coley K.P., Karram M. Safety, tolerability and short-term efficacy of transvaginal fractional bipolar radiofrequency therapy for symptoms of stress and or mixed incontinence in conjunction with genitourinary syndrome of menopause. Neurourol Urodyn 2023; 42(4): 807–813.
- Soares-Júnior J.M., Barbosa M.T.A., Aguiar L.M., et al. Energy-based devices in gynecology: the new frontier for the treatment of genitourinary syndrome of postmenopause? Clinics (Sao Paulo) 2021; 76: e3066.
Реклама. ООО «КИТ МЕД»


