ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ ЭПИДЕРМИСА: ПРИСТАЛЬНЫЙ ВЗГЛЯД
14.01.2021
К 2025 г. прогнозируемая продолжительность жизни в развитых странах достигнет 100 лет. Это приведет к увеличению численности пожилого населения, а значит, и частоты ассоциированных со старением заболеваний, в том числе кожных.
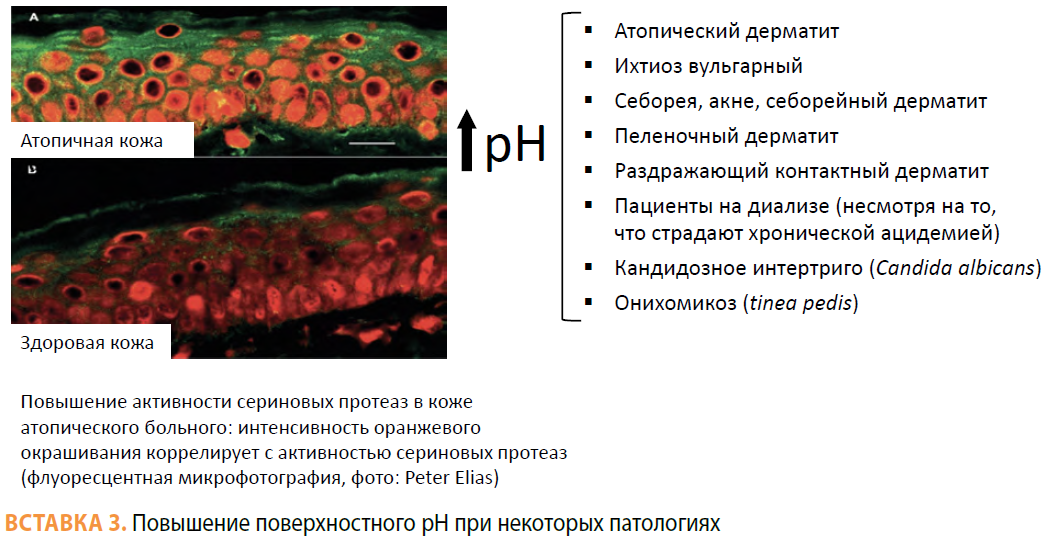
В возрасте 50+ в результате структурных изменений кожи начинает развиваться дисфункция эпидермиса, которая выражается в снижении гидратации рогового слоя, нарушении проницаемости барьера, повышении поверхностного рН. На этом фоне увеличивается риск развития или обостряются различные кожные патологии, в том числе атопический дерматит, контактный дерматит, зуд, ксероз.
В обзоре, выполненном группой специалистов под руководством Питера Элиаса, одного из начальников корнеотерапии, обсуждаются возрастные изменения эпидермиса, их связь с разными заболеваниями и способы профилактики и коррекции. Приводим часть перевода этого обзора.
Функции эпидермиса, меняющиеся с возрастом
На рисунке представлены все основные изменения эпидермиса, наблюдающиеся с возрастом. Остановимся на каждом из них подробнее.
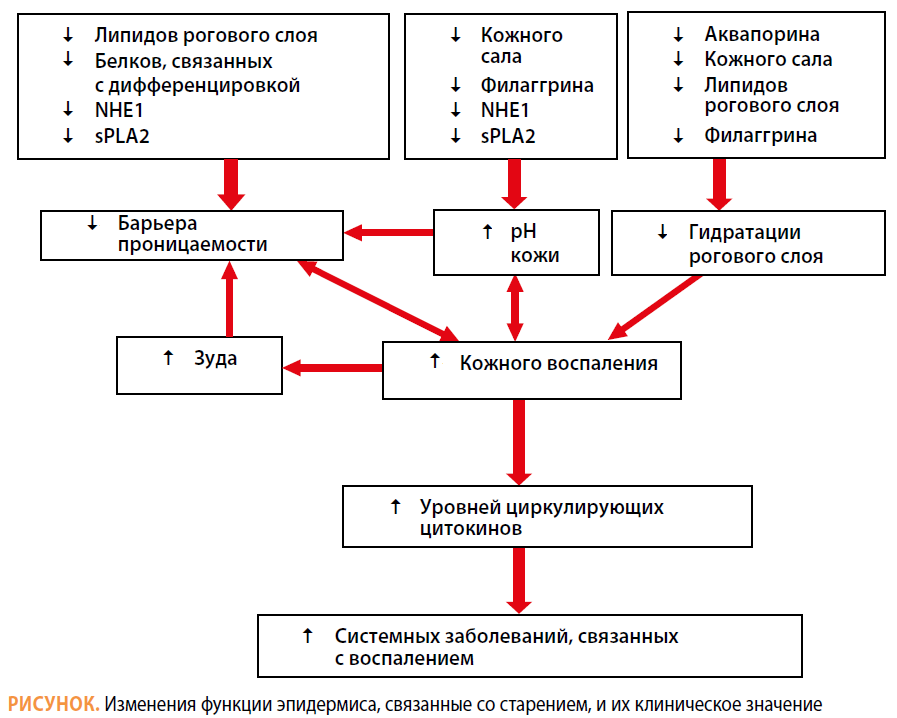
Изменение барьерной функции
Оценка барьерной функции рогового слоя проводится путем измерения трансэпидермальной потери воды (ТЭПВ) — при нарушении барьера данный показатель резко возрастает.
У неповрежденной кожи средние нормальные значения ТЭПВ варьируют в зависимости от пола, участка тела, пигментации кожи. Что касается корреляции ТЭПВ с возрастом, то информации на эту тему не так много, и она в определенной степени противоречива. Так, в ряде работ говорится о том, что средние уровни ТЭПВ на некоторых участках тела у пожилых людей могут быть ниже, чем у молодых [1, 2], что на первый взгляд свидетельствует о более надежном барьере возрастной кожи. Вместе с тем в области декольте наблюдается возрастное увеличение ТЭПВ, что говорит об обратном [3]. На шее, предплечьях и кистях рук уровни ТЭПВ сопоставимы у молодых и пожилых женщин [3]. Также было установлено, что параметр ТЭПВ в среднем выше у пожилых женщин, чем у пожилых мужчин [4].
Несмотря на разбор результатов, ясно одно — уровни ТЭПВ в здоровой неповрежденной коже людей разного возраста хоть и несколько отличаются, но не настолько критично, чтобы говорить о патологическом нарушении барьерной функции при старении кожи. Однако возрастная проблема все же существует — после повреждения рогового слоя восстановление барьерной функции у пожилых людей происходит значительно медленнее по сравнению с более молодыми людьми. Этому есть объяснение, и оно заключается в биохимических и структурных изменениях в эпидермисе, которые проявляются с возрастом.
Напомним, что барьер проницаемости кожи локализован в роговом слое. Он состоит из корнеоцитов, заполненных кератином и окруженных белковым роговым конвертом, и чередующихся липидных и водных пластов, расположенных между корнеоцитами и регулирующих диффузию низкомолекулярных веществ через роговой слой. Функционирование барьера в значительной степени определяется количеством и качеством белковых и липидных компонентов, которые формируются в ходе созревания кератиноцитов и их финального превращения в корнеоциты.
Эпидермальный фактор роста. В эпидермисе стареющей кожи уровень эпидермального фактора роста снижается вместе с замедлением скорости деления базальных кератиноцитов. В то же время увеличивается число апоптозов кератиноцитов. Все эти приводит к истончению как живых слоев эпидермиса, так и рогового слоя [5, 6].
Ионы кальция. С возрастом наблюдается изменение градиента концентрации ионов кальция в эпидермисе — еще одного важного фактора, контролирующего деление и созревание кератиноцитов и формирование рогового слоя. Так, в базальном и шиповатом слоях эпидермиса пожилых людей концентрация кальция более высокая, что тормозит пролиферацию кератиноцитов [7, 8]. В гранулярном слое, напротив, уровень кальция падает, и это ухудшает созревание белков рогового слоя (филаггрин, лорикрин и др.) [9–11], что может привести к формированию дефектных корнеоцитов и изменению барьера проницаемости.
Межклеточные липидные пласты рогового слоя (липидный барьер). Что касается межклеточных липидных пластов, являющихся основой липидного барьера рогового слоя, то в них также выявляются возрастные изменения. Для формирования липидного барьера требуются холестерин, свободные жирные кислоты и церамиды примерно в равном молярном соотношении [12]. Эти липиды синтезируются кератиноцитами, и дефицит любого из них может привести к дефектам в барьерных структурах [13]. Исследования показали, что в «старом» роговом слое наблюдается снижение общего содержания липидов более чем на 30% по сравнению с «молодым» [2], что связано с ослаблением синтетической активности кератиноцитов — как в интактном состоянии, так и после острого повреждения. Аппликация смеси барьерных липидов может улучшить функцию барьера у пожилых людей, и это обстоятельство, в свою очередь, подтверждает наличие возрастной барьерной дисфункции [14].
рН рогового слоя. Одним из этапов формирования липидного барьера является ферментативное превращение предшественников липидов в барьерные липиды, и это превращение осуществляется уже вне кератиноцитов во внеклеточных пространствах рогового слоя [15]. Кроме ферментов, ответственных за липидный барьер, в роговом слое есть ферменты, обеспечивающие своевременное отшелушивание роговых чешуек путем разрушения корнеодесмосом (протеолитические ферменты). Все ферменты рогового слоя, как и любые другие ферменты, очень чувствительны к рН своего микроокружения. В роговом слое существует градиент рН — с кислого значения порядка 5,5 (гидролипидная мантия на поверхности кожи) к слабощелочному около 7,2 (на границе с гранулярным слоем). Таким образом, на разной глубине рогового слоя будет свой уровень рН, контролирующий работу ферментов на данной глубине (см. Вставку 1. — Прим. ред.).
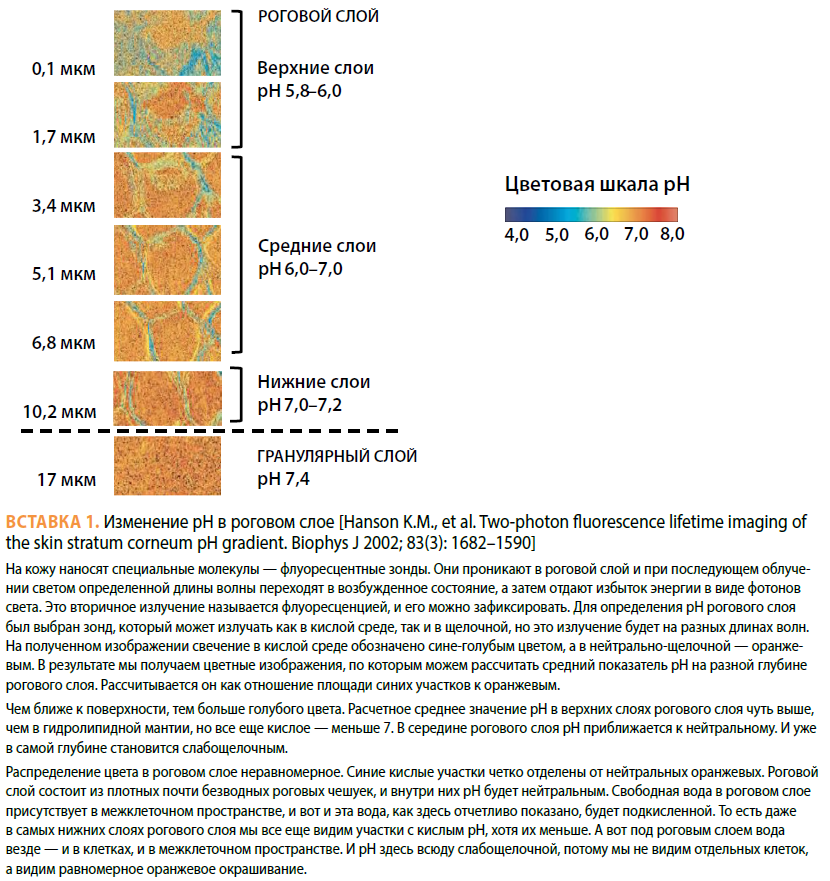
С возрастом наблюдается тенденция к повышению поверхностного рН [16–17], что меняет градиент рН через роговой слой, и это сказывается на активности ферментов — протеолитические ферменты в середине и на поверхности рогового слоя при повышении рН активируются, что ускоряет отшелушивание. Напротив, ферменты, отвечающие за липидный барьер, при повышении рН угнетаются, что приводит к формированию измененного липидного барьера. Все это в совокупности приводит к ослаблению барьера проницаемости рогового слоя (см. Вставки 2 и 3. — Прим. ред.).
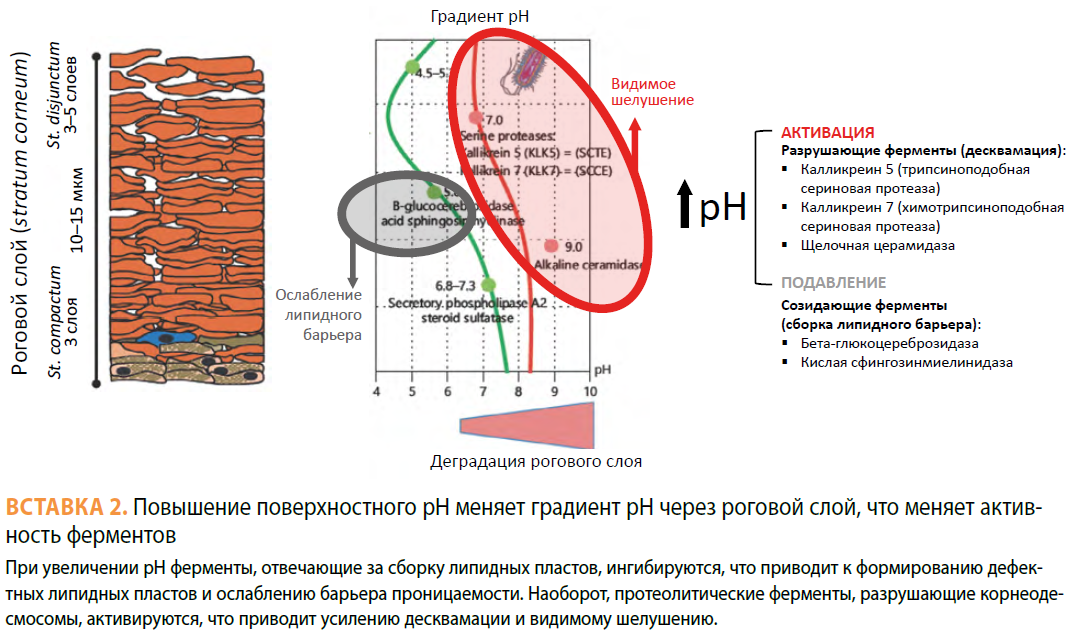
Аппликация препаратов с нейтральным рН задерживает восстановление барьера, напротив, подкисление рогового слоя ускоряет восстановление барьера как в молодой, так и в возрастной коже [18–20].
Глюкокортикоиды и кортизол. Биологическое старение сопровождается увеличением секреции глюкокортикоидов и повышением уровня кортизола в коже [5, 21]. Исследования показали, что системное или местное применение глюкокортикоидов тормозит пролиферацию кератиноцитов и ослабляет барьер [22]. В коже под действием 11β-гидроксистероиддегидрогеназы 1 кортизон превращается в активную форму — кортизол [23]. В возрастной коже активность этого фермента выше по сравнению с молодой [24], и это отрицательно сказывается на способности эпидермиса к восстановлению и формированию барьера [25]. Ингибирование 11β-гидроксистероиддегидрогеназы 1 не только корректирует вызванные глюкокортикоидами эпидермальные функциональные нарушения, но и способствует восстановлению структуры барьера [26, 27].
Другие факторы. Есть и другие факторы, связанные со старением изменения кожи, которые могут способствовать изменению функции эпидермиса. Например, по сравнению с молодым эпидермисом в стареющем эпидермисе наблюдается более чем 60% снижение уровня белка-антагониста рецептора ИЛ-1, а дефицит рецептора ИЛ-1α типа 1 задерживает восстановление барьера [28]. Напротив, как повышение экспрессии, так и введение ИЛ-1α укрепляет барьер как в стареющей коже, так и в коже плода [29, 30].
В стареющей коже также наблюдается снижение количества гиалуроновой кислоты. Исследования показали: местное применение гиалуроновой кислоты стимулирует дифференцировку кератиноцитов и выработку липидов, что приводит к усилению функции эпидермального барьера проницаемости как в молодой, так и в пожилой коже [31, 32].
Наконец, с возрастом наблюдается снижение экспрессии эпидермального аквапорина-3 — белка, формирующего водные каналы в мембране кератиноцитов и отвечающего за внутриклеточный водный баланс [32-34]. Выключение гена, кодирующего аквапорин-3, задерживает восстановление барьера проницаемости [35]. Напротив, усиление экспрессии аквапорина-3 улучшает барьерную функцию [36].
Снижение гидратации рогового слоя
Примерно после 40 лет уровень гидратации рогового слоя начинает снижаться. Механизмы, лежащие в основе уменьшения гидратации рогового слоя в стареющей коже, можно объяснить дефицитом веществ, входящих в водорегулирующие и водоудерживающие его структуры.
Во-первых, в роговом слое стареющей кожи снижается количество барьерных липидов [2, 37], в том числе церамидов [38]. Их дефицит можно компенсировать путем перорального или местного применения церамидов, что приводит к повышению гидратации рогового слоя [39, 40].
Во-вторых, снижается уровень филаггрина [11] и его метаболитов, включая транс-урокановую и пироглутаминовую кислоты, входящие в состав натурального увлажняющего фактора (NMF). Аппликации этих веществ, а также и других компонентов NMF, таких как свободные аминокислоты, молочная кислота и мочевина, способствуют повышению гидратации рогового слоя.
В-третьих, в возрастной коже по сравнению с молодой ниже продукция себума в целом и глицерина в частности [16, 41]. Себум вместе с секретом потовых желез формирует гидролипидную мантию, регулирующую испарение воды с поверхности кожи. Если мантия нарушена, испарение усиливается, поэтому в себодефицитной коже наблюдается снижение гидратации рогового слоя, и аппликация препаратов, имитирующих гидролипидную мантию, помогает ее восстановить.
Наконец, в возрастном эпидермисе снижается уровень аквапорина-3 [33–35]. Это ухудшает движение воды в живых слоях эпидермиса и способствует развитию застойных явлений, на фоне которых тормозится деление и созревание кератиноцитов. Аквапориновые каналы могут активироваться в присутствии небольшого количества глицерина (несколько процентов) в окружающей среде [42], высокие концентрации глицерина (свыше 10%), напротив, ингибируют их работу.
Повышение pH поверхности кожи
Значение pH поверхности кожи человека в первые две недели жизни обычно выше, к 5–6-й нед оно снижается до среднего 5,5 [43]. После 55 лет pH поверхности кожи имеет тенденцию к повышению, и у людей старше 70 это повышение становится существенным [16, 18]. Нормальные значения pH поверхности кожи человека зависят от пола и участка тела [44].
Возрастное повышение рН поверхности кожи связано с несколькими факторами. Один из них — уменьшение продукции себума и, соответственно, количества триглицеридов [3, 16], из которых высвобождаются свободные жирные кислоты, подкисляющие гидролипидную мантию и поверхность рогового слоя [45]. В нижних слоях роговой слой подкисляется благодаря высвобождению свободных жирных кислот из фосфолипидов клеточных мембран под действием секреторной фосфолипазы 2 (sPLA2) [46], экспрессия которой заметно снижается с возрастом.
Натрий-водородный обменник 1 (NHE1) — еще один механизм, регулирующий градиент pH в роговом слое: при дефиците NHE1 pH поверхности кожи повышается [47]. В стареющей коже экспрессия NHE1 значительно ниже, чем в молодой коже, что может способствовать повышению поверхностного рН.
И наконец, в стареющей коже наблюдается низкий уровень экспрессии филаггрина [10], который может расщепляться до транс-урокановой кислоты по филаггрин-гистидин-урокановокислотному пути [48]. Урокановая кислота подкисляет роговой слой [49].
Узнать больше о последствиях возрастных изменений эпидермиса, а также подходах к улучшению эпидермальных функций в стареющей коже — что именно нужно делать, чтобы поддержать здоровье кожи, вы можете в полной версии статьи, опубликованной у журнале «Косметика и медицина» №4-2020. Журнал доступен в печатной и электронной версии. Рекомендуем — там еще много очень интересных материалов!
Литература:
© Wang Z., Man M.Q., Tienan L., et al. Aging-associated alterations in epidermal function and their clinical significance. Aging 2020; 12(6): 5551–5565. Перевод и публикация в сокращенном виде — в соответствии с лицензией Creative Commons Attribution License.
- Boireau-Adamezyk E., Baillet-Guffroy A., Stamatas G.N. Age-dependent changes in stratum corneum barrier function. Skin Res Technol 2014; 20(4): 409–415.
- Ghadially R., Brown B.E., Sequeira-Martin S.M., et al. The aged epidermal permeability barrier. Structural, functional, and lipid biochemical abnormalities in humans and a senescent murine model. J Clin Invest 1995; 95(5): 2281–2290.
- Luebberding S., Krueger N., Kerscher M. Age-related changes in skin barrier function — quantitative evaluation of 150 female subjects. Int J Cosmet Sci 2013a; 35(2): 183–190.
- Luebberding S., Krueger N., Kerscher M. Skin physiology in men and women: in vivo evaluation of 300 people including TEWL, SC hydration, sebum content and skin surface pH. Int J Cosmet Sci 2013b; 35(5): 477–483.
- Kinn P.M., Holdren G.O., Westermeyer B.A., et al. Age-dependent variation in cytokines, chemokines, and biologic analytes rinsed from the surface of healthy human skin. Sci Rep 2015; 5: 10472.
- Gilhar A., Ullmann Y., Karry R., et al. Aging of human epidermis: reversal of aging changes correlates with reversal of keratinocyte fas expression and apoptosis. J Gerontol A Biol Sci Med Sci 2004; 59(5): 411–415.
- Micallef L., Belaubre F., Pinon A., et al. Effects of extracellular calcium on the growth-differentiation switch in immortalized keratinocyte HaCaT cells compared with normal human keratinocytes. Exp Dermatol 2009; 18(2): 143–151.
- Denda M., Tomitaka A., Akamatsu H., Matsunaga K. Altered distribution of calcium in facial epidermis of aged adults. J Invest Dermatol 2003; 121(6): 1557–1558.
- Tezuka T., Qing J., Saheki M., et al. Terminal differentiation of facial epidermis of the aged: immunohistochemical studies. Dermatology 1994; 188(1): 21–24.
- Rinnerthaler M., Duschl J., Steinbacher P., et al. Age-related changes in the composition of the cornified envelope in human skin. Exp Dermatol 2013; 22(5): 329–335.
- Takahashi M., Tezuka T. The content of free amino acids in the stratum corneum is increased in senile xerosis. Arch Dermatol Res 2004; 295(10): 448–452.
- Man M.Q., Feingold K.R., Thornfeldt C.R., Elias P.M. Optimization of physiological lipid mixtures for barrier repair. J Invest Dermatol. 1996; 106(5): 1096–1101.
- Feingold K.R., Elias P.M. Role of lipids in the formation and maintenance of the cutaneous permeability barrier. Biochim Biophys Acta 2014; 1841(3): 280–294.
- Zettersten E.M., Ghadially R., Feingold K.R., et al. Optimal ratios of topical stratum corneum lipids improve barrier recovery in chronologically aged skin. J Am Acad Dermatol 1997; 37(3 Pt 1): 403–408.
- Man M.Q., Feingold K.R., Jain M., Elias P.M. Extracellular processing of phospholipids is required for permeability barrier homeostasis. J Lipid Res 1995; 36(9): 1925–1935.
- Man M.Q., Xin S.J., Song S.P., et al. Variation of skin surface pH, sebum content and stratum corneum hydration with age and gender in a large Chinese population. Skin Pharmacol Physiol 2009; 22(4): 190–199.
- Schreml S., Zeller V., Meier R.J., et al. Impact of age and body site on adult female skin surface pH. Dermatology 2012; 224(1): 66–71.
- Choi E.H., Man M.Q., Xu P., et al. Stratum corneum acidification is impaired in moderately aged human and murine skin. J Invest Dermatol 2007; 127(12): 2847–2856.
- Hachem J.P., Roelandt T., Schürer N., et al. Acute acidification of stratum corneum membrane domains using polyhydroxyl acids improves lipid processing and inhibits degradation of corneodesmosomes. J Invest Dermatol 2010; 130(2): 500–510.
- Hachem J.P., Crumrine D., Fluhr J., et al. pH directly regulates epidermal permeability barrier homeostasis, and stratum corneum integrity/cohesion. J Invest Dermatol 2003; 121(2): 345–353.
- Yiallouris A., Tsioutis C., Agapidaki E., et al. Adrenal Aging and Its Implications on Stress Responsiveness in Humans. Front Endocrinol (Lausanne) 2019; 10: 54.
- Kao J.S., Fluhr J.W., Man M.Q., et al. Short-term glucocorticoid treatment compromises both permeability barrier homeostasis and stratum corneum integrity: inhibition of epidermal lipid synthesis accounts for functional abnormalities. J Invest Dermatol 2003; 120(3): 456–464.
- Tomlinson J.W., Walker E.A., Bujalska I.J., et al. 11beta-hydroxysteroid dehydrogenase type 1: a tissue-specific regulator of glucocorticoid response. Endocr Rev 2004; 25(5): 831–866.
- Tiganescu A., Walker E.A., Hardy R.S., et al. Localization, age- and site-dependent expression, and regulation of 11β-hydroxysteroid dehydrogenase type 1 in skin. J Invest Dermatol 2011; 131(1): 30–36.
- Choe S.J., Kim D., Kim E.J., et al. Psychological Stress Deteriorates Skin Barrier Function by Activating 11β-Hydroxysteroid Dehydrogenase 1 and the HPA Axis. Sci Rep 2018; 8(1): 6334.
- Tiganescu A., Hupe M., Uchida Y., et al. Topical 11β-Hydroxysteroid Dehydrogenase Type 1 Inhibition Corrects Cutaneous Features of Systemic Glucocorticoid Excess in Female Mice. Endocrinology 2018; 159(1): 547–556.
- Tiganescu A., Tahrani A.A., Morgan S.A., et al. 11β-Hydroxysteroid dehydrogenase blockade prevents age-induced skin structure and function defects. J Clin Invest 2013; 123(7): 3051–3060.
- Ye J., Garg A., Calhoun C., et al. Alterations in cytokine regulation in aged epidermis: implications for permeability barrier homeostasis and inflammation. I. IL-1 gene family. Exp Dermatol 2002; 11(3): 209–216.
- Barland C.O., Zettersten E., Brown B.S., et al. Imiquimod-induced interleukin-1 alpha stimulation improves barrier homeostasis in aged murine epidermis. J Invest Dermatol 2004; 122(2): 330–336.
- Jiang Y.J., Lu B., Crumrine D., et al. IL-1alpha accelerates stratum corneum formation and improves permeability barrier homeostasis during murine fetal development. J Dermatol Sci 2009; 54(2): 88–98.
- Bourguignon L.Y., Ramez M., Gilad E., et al. Hyaluronan-CD44 interaction stimulates keratinocyte differentiation, lamellar body formation/secretion, and permeability barrier homeostasis. J Invest Dermatol 2006; 126(6): 1356–1365.
- Bourguignon L.Y., Wong G., Xia W., et al. Selective matrix (hyaluronan) interaction with CD44 and RhoGTPase signaling promotes keratinocyte functions and overcomes age-related epidermal dysfunction. J Dermatol Sci 2013; 72(1): 32–44.
- Li J., Tang H., Hu X., et al. Aquaporin-3 gene and protein expression in sun-protected human skin decreases with skin ageing. Australas J Dermatol 2010; 51(2): 106–112.
- Ikarashi N., Kon R., Kaneko M., et al. Relationship between Aging-Related Skin Dryness and Aquaporins. Int J Mol Sci 2017; 18(7): E1559.
- Hara M., Ma T., Verkman A.S. Selectively reduced glycerol in skin of aquaporin-3-deficient mice may account for impaired skin hydration, elasticity, and barrier recovery. J Biol Chem 2002; 277(48): 46616–46621.
- Schrader A., Siefken W., Kueper T., et al. Effects of glyceryl glucoside on AQP3 expression, barrier function and hydration of human skin. Skin Pharmacol Physiol 2012; 25(4): 192–199.
- Rogers J., Harding C., Mayo A., et al. Stratum corneum lipids: the effect of ageing and the seasons. Arch Dermatol Res 1996; 288(12): 765–770.
- Imokawa G., Abe A., Jin K., et al. Decreased level of ceramides in stratum corneum of atopic dermatitis: an etiologic factor in atopic dry skin? J Invest Dermatol 1991; 96(4): 523–526.
- Bizot V., Cestone E., Michelotti A., Nobile V. Improving Skin Hydration and Age-related Symptoms by Oral Administration of Wheat Glucosylceramides and Digalactosyl Diglycerides: A Human Clinical Study. Cosmetics 2017; 4(4): 37.
- Huang H.C., Chang T.M. Ceramide 1 and ceramide 3 act synergistically on skin hydration and the transepidermal water loss of sodium lauryl sulfate-irritated skin. Int J Dermatol 2008; 47(8): 812–819.
- Choi E.H., Man M.Q., Wang F., et al. Is endogenous glycerol a determinant of stratum corneum hydration in humans? J Invest Dermatol 2005; 125(2): 288–293.
- Dumas M., Sadick N.S., Noblesse E., et al. Hydrating skin by stimulating biosynthesis of aquaporins. J Drugs Dermatol 2007; 6(6 Suppl): s20–s24.
- Fluhr J.W., Darlenski R., Lachmann N., et al. Infant epidermal skin physiology: adaptation after birth. Br J Dermatol 2012; 166(3): 483–490.
- Zlotogorski A. Distribution of skin surface pH on the forehead and cheek of adults. Arch Dermatol Res 1987; 279(6): 398–401.
- Yamamoto A., Serizawa S., Ito M., Sato Y. Effect of aging on sebaceous gland activity and on the fatty acid composition of wax esters. J Invest Dermatol 1987; 89(5): 507–512.
- Fluhr J.W., Kao J., Jain M., et al. Generation of free fatty acids from phospholipids regulates stratum corneum acidification and integrity. J Invest Dermatol 2001; 117(1): 44–51.
- Behne M.J., Meyer J.W., Hanson K.M., et al. NHE1 regulates the stratum corneum permeability barrier homeostasis. Microenvironment acidification assessed with fluorescence lifetime imaging. J Biol Chem 2002; 277(49): 47399–47406.
- Vávrová K., Henkes D., Strüver K., et al. Filaggrin deficiency leads to impaired lipid profile and altered acidification pathways in a 3D skin construct. J Invest Dermatol 2014; 134(3): 746–753.
- Krien P.M., Kermici M. Evidence for the existence of a self-regulated enzymatic process within the human stratum corneum -an unexpected role for urocanic acid. J Invest Dermatol 2000; 115(3): 414–420.